Naissance du chaton

Croissance
À la naissance, le poids du chaton est environ de 100 g. Plus précisément, selon les auteurs, il pèse : 101,6 ± 19,4 g (Lecourtois, 2018), entre 85 et 120 g (Kirk et al., 2000), 100 ± 10 g (Greco et Watters, 1990 ; Grundy, 2006).
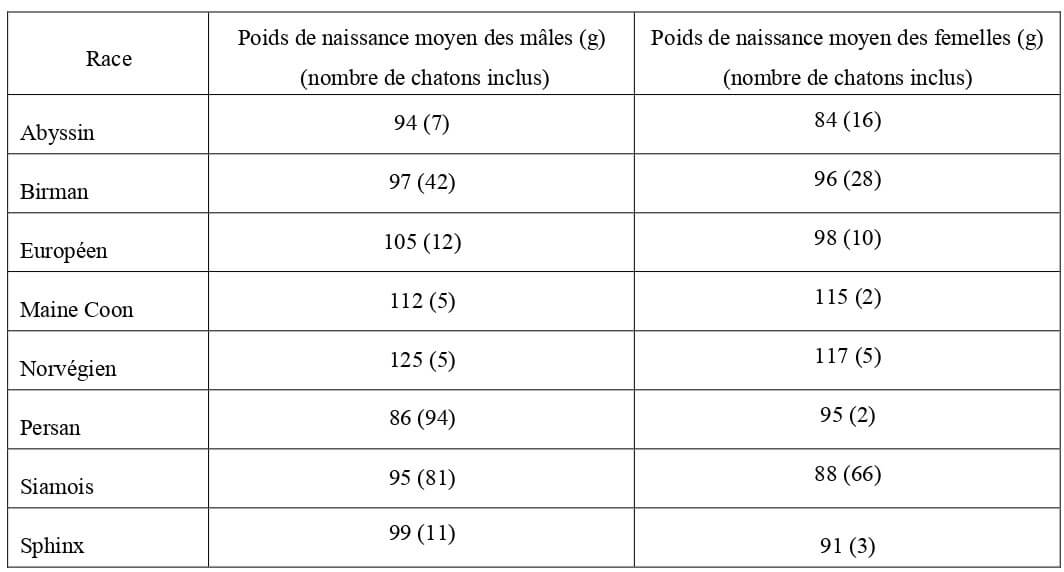
Il varie de façon significative en fonction de la race du chaton (Tableau 2) et dans une moindre mesure en fonction de son sexe (Tableau 1). Le poids de naissance est diminué en cas de sous nutrition maternelle (Paragon et al., 2003). L’influence de la taille de la portée est controversée (Hoskins, 1990 ; Paragon et al., 2003).
Tableau 1 : Poids de naissance moyens selon le sexe du chaton.
Tableau 2 : Poids de naissance moyens selon le sexe et la race chez le chaton (Dubos, 1997).
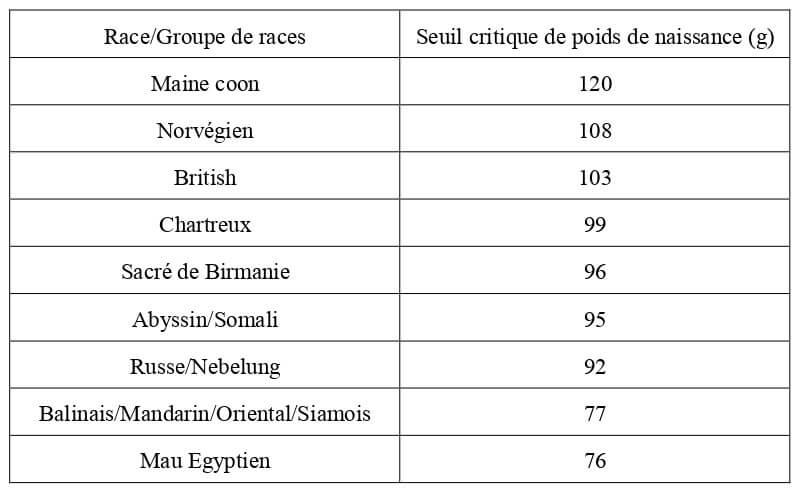
En deçà d’une valeur seuil de poids de naissance, le risque de mortalité néonatale est accru. Grundy considère que celle-ci est de 90 g. Lecourtois considère qu’en fonction de la race, ce poids varie. Il est par exemple de 76 g pour le Mau Egyptien, contre 120 g pour le Maine Coon (Tableau 3).
Tableau 3 : Seuils critiques de poids de naissance par race ou groupe de races vis-à-vis du risque de mortalité néonatale (Lecourtois, 2018).
Système cardio-vasculaire
Anatomie cardio-vasculaire
Retour sur la circulation chez le fœtus à la fin de la gestation :
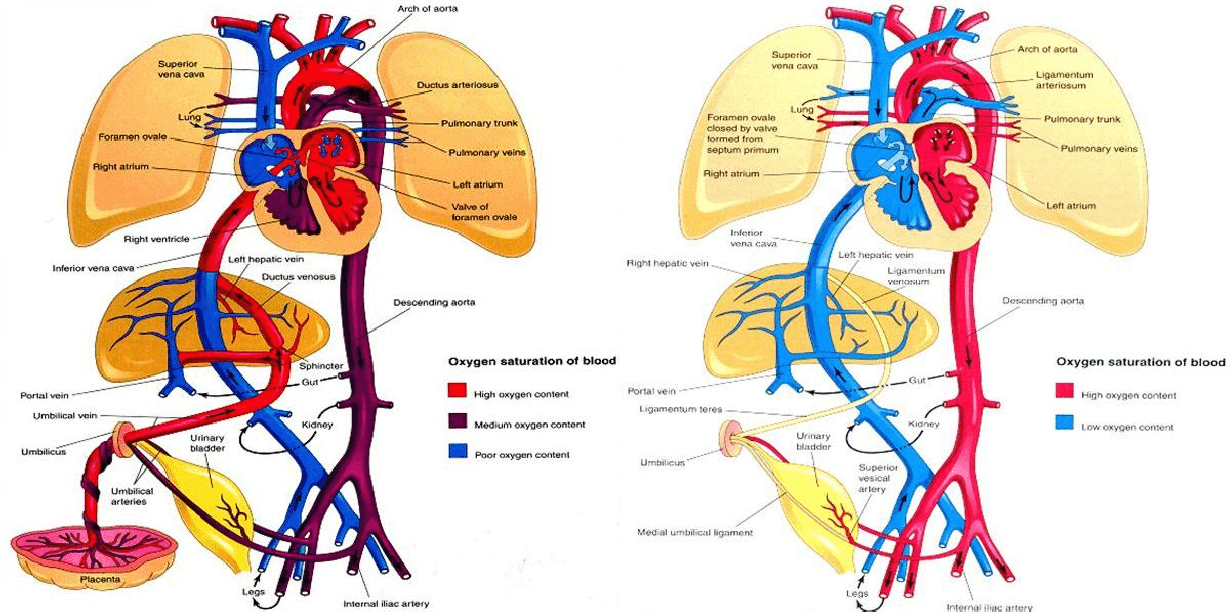
Au cours de la gestation, l’oxygénation du fœtus a lieu à travers le placenta. Le sang oxygéné arrive au fœtus par voie veineuse, via la veine ombilicale (Figure 1). Il pénètre ensuite dans l’organisme par le foie, et passe directement dans la veine cave par l’intermédiaire d’un vaisseau strictement fœtal : le ductus venosus (ou canal veineux). Il atteint finalement le cœur au niveau de l’oreillette droite. Une partie de ce sang part dans le ventricule droit, tandis que l’autre se retrouve dans l’oreillette gauche. En effet, chez le fœtus, il existe une communication entre les deux oreillettes : c’est le foramen ovale, ou trou de Botal (Figure 1). De l’oreillette au ventricule gauche, le sang poursuit son trajet dans l’aorte. Là encore, une communication propre au fœtus rentre en jeu entre l’artère pulmonaire et l’aorte : le canal artériel. Le sang moyennement oxygéné issu du mélange de ces deux vaisseaux fournit la circulation systémique et irrigue les organes tels que les reins, la vessie ou les intestins. Il finit sa route dans les artères ombilicales qui renvoient vers le placenta le sang peu oxygéné (Figure 1) (Voldoire, 2002).
A la naissance, le cordon ombilical est composé de deux artères, une veine et du canal de l’Ouraque. Il est étiré au moment de l’expulsion du nouveau-né et coupé par la mère à l’aide de ses dents, à quelques centimètres de l’abdomen du fœtus. La circulation d’origine placentaire cesse, les échanges de gaz s’effectuent à présent dans les poumons (Figure 1). Les shunts fœtaux se ferment (Root Kustritz, 2011) : les canaux artériel (entre l’artère pulmonaire et l’aorte) et veineux (entre la veine ombilicale et la veine cave) se ferment en premier, 30 minutes après la naissance, puis le foramen ovale (communication entre les deux oreillettes) subit une fermeture fonctionnelle. C’est-à-dire qu’il est maintenu fermé par la différence de pression entre les deux oreillettes (plus importante à gauche qu’à droite) mais est susceptible de se rouvrir si les pressions s’inversent (Voldoire, 2002).
Figure 1 : Circulations fœtale et postnatale chez l’humain (Jean-Luc Bigras, Service de Cardiologie CHU Sainte-Justine, Université de Montréal). Le fonctionnement est semblable chez le chat.
A la naissance, le cœur du chaton est quasi-symétrique : le ratio des masses ventriculaires droite sur gauche est quasiment de 1/1 contrairement à l’adulte (Bishop, 1999).
Fonction cardiaque
- Auscultation
Fréquence et rythme cardiaques :
L’auscultation du cœur est difficile du fait de la taille du thorax et de la fréquence cardiaque élevée. Elle doit se réaliser à gauche, au niveau de l’apex cardiaque, entre le cinquième et le sixième espace intercostal, dans le tiers ventral du thorax. L’usage d’un stéthoscope pédiatrique est conseillé (Root Kustritz, 2011).
La fréquence cardiaque normale d’un chaton est d’environ 200 à 250 battements par minute (bpm) le jour de la naissance (McIntosh Brigh et Holmberg, 1990).
Le rythme cardiaque est un rythme cardiaque sinusal régulier chez le chaton de moins de 6 semaines (McIntosh Bright et Holmberg, 1990).
Souffles physiologiques :
Des souffles cardiaques de grades 1/6 à 3/6 entendus chez les chatons nouveau-nés sont le plus souvent causés par le flux sanguin aortique ou pulmonaire rapide ou des délais variables de fermeture des shunts intracardiaques ou entre le cœur et les grands vaisseaux (Root Kustritz, 2011). Les souffles de grades 4/6 à 6/6 sont généralement dus à des malformations cardiaques congénitales. Les plus fréquentes chez le chat sont la dysplasie de la valve tricuspide et l’aplasie du septum ventriculaire (Root Kustritz, 2011).
- Electrocardiogramme
L’électrocardiographie (ECG) est rarement réalisée sur des nouveau-nés mais permettrait de détecter des arythmies ou des défauts de conduction.
L’onde P présente une amplitude et durée semblables à celles de l’adulte. La durée et l’amplitude du complexe QRS et des intervalles PR et QT le sont également (Lourenço et Ferreira, 2003).
- Pression artérielle
La pression artérielle du chaton est comprise entre 40 à 50 mmHg. Ces faibles valeurs sont dues aux parois musculaires artérielles immatures et à une faible résistance artérielle périphérique. Chez le chaton nouveau-né, l’analyse des variations de la pression sanguine ne permet pas de diagnostiquer un choc hypovolémique (Giry, 2002).
- Adaptabilité cardiaque
Le chaton nouveau-né présente un débit cardiaque, un volume plasmatique, une pression veineuse centrale et une post-charge plus élevés que chez l’adulte. Au contraire, la pression artérielle moyenne, le volume d’éjection systolique, la résistance vasculaire périphérique et la précharge sont plus faibles (McIntosh Bright et Holmberg, 1990). La masse myocardique contractile et la compliance ventriculaire (capacité des ventricules à se dilater) sont également plus faibles. Ainsi, la réserve cardiaque est faible et le volume d’éjection systolique ne varie pas (Giry, 2002). Le débit cardiaque du chaton (DC = VES x FC avec DC : Débit cardiaque (L/min) ; VES : Volume d’éjection systolique (L) ; FC : Fréquence cardiaque (bpm)) ne dépend donc que de la fréquence cardiaque (McIntosh Bright et Holmberg, 1990).
De ce fait, le cœur du chaton a une très faible capacité d’adaptation en fonction des évènements (repos/exercice). De plus, le contrôle nerveux de la fréquence cardiaque est mauvais chez le chaton nouveau-né. Le myocarde est moins dense en fibres sympathiques que celui du chat adulte. A la naissance, le cœur du chaton est incapable notamment de répondre à une hypovolémie par une tachycardie. Ainsi, il est sensible aux pertes sanguines, même peu importantes (5-10 mL/kg). Ceci est à prendre en compte lors de prélèvements sanguins notamment (ils ne doivent pas excéder 0,5 mL pour 100 g de poids corporel) (McIntosh Bright et Holmberg, 1990).
Système respiratoire
Anatomie et physiologie de l’arbre respiratoire
Durant les derniers jours précédant la mise-bas, les muscles respiratoires du fœtus commencent à fonctionner. Les poumons sont remplis de liquide et vides d’air. En post- partum immédiat, la première inspiration permet l’expansion des poumons (Moon et al., 2001). Ces derniers ne sont cependant pas encore totalement développés (Root Kustritz, 2011).
D’une part, le nouveau-né possède des particularités anatomiques qui rendent son appareil respiratoire moins efficace que celui d’un adulte (Giry, 2002). Dans un premier temps, ses voies respiratoires sont souples et de petit diamètre. Ceci induit une résistance à l’écoulement de l’air plus importante que chez l’adulte, et par conséquent un effort respiratoire plus intense. De plus, les risques d’obstruction sont plus élevés (Giry, 2002). Deuxièmement, la cage thoracique du chaton est souple et sa capacité résiduelle fonctionnelle est plus faible que chez l’adulte. En conséquence, la fermeture des voies aériennes périphériques, et donc le maintien d’une pression intra-thoracique négative, sont rendus plus difficiles (Giry, 2002).
Par ailleurs, l’appareil respiratoire du chaton est très sensible à la température de l’air, à sa teneur en oxygène, à ses composants toxiques ou irritants et aux agents infectieux qu’il contient (Grundy, 2006).
D’autre part, le chaton qui vient de naître a des besoins en oxygène deux à trois fois plus importants que l’adulte (Voldoire, 2002). C’est pourquoi il a une fréquence respiratoire plus élevée que ce dernier : entre 10 et 18 mouvements par minutes à la naissance (Little, 2011). Ce besoin important en oxygène peut être expliqué par plusieurs particularités : la taille importante de la langue par rapport à la cavité buccale (qui restreint le passage de l’air) (Voldoire, 2002) et le volume courant, inférieur à celui de l’adulte (Moon et al., 2001). L’amplitude respiratoire est également plus faible (Root Kustritz, 2011).
Le chaton nouveau-né se voit donc forcé de fournir un effort respiratoire supérieur à celui de l’adulte, alors que sa résistance à la fatigue musculaire est réduite (Moon et al., 2001). Tout ceci doit être pris en compte lors de l’examen clinique de la fonction respiratoire.
Surfactant
Durant la fin de vie fœtale, l’épithélium pulmonaire du chaton synthétise le surfactant sous forme de film. Ce fluide recouvre la surface alvéolaire interne, diminuant ainsi de façon drastique la tension de surface. Il permet également d’augmenter la compliance pulmonaire et de stabiliser les alvéoles et les bronchioles terminales, de maintenir une capacité résiduelle fonctionnelle et de diminuer le travail respiratoire. Finalement, il a un effet cytoprotecteur au niveau alvéolaire.
La qualité et la quantité de surfactant sont deux éléments déterminants au moment de la naissance. Si elles sont insuffisantes, on assiste généralement à une détresse respiratoire aiguë chez le nouveau-né (appelée Syndrome de détresse respiratoire ou Maladie des membranes hyalines). Ceci résulte de la réduction des échanges gazeux, par réduction de la compliance pulmonaire. De plus, le surfactant agit comme un protecteur des membranes face à l’action irritante de l’oxygène. Ce dernier provoque une inflammation des parois alvéolaires et la formation de membranes hyalines dans les voies respiratoires inférieures. Lors de césarienne avant le terme de la gestation ou lors de naissance prématurée, le développement suffisant du surfactant est incertain (Root Kustritz, 2011).
Des études chez le chien ont montré que les fœti femelles commençaient la synthèse de surfactant en moyenne 1 jour avant les fœti mâles (62 jours de gestation pour les femelles contre 63 jours pour les mâles) (Root Kustritz, 2011). Aucune donnée similaire n’est disponible chez le chaton.
Face à l’hypoxie, l’organisme du chaton à la naissance réagit de façon opposée à celui de l’adulte. En effet, il répond par une bradycardie et bradypnée avec une baisse du niveau de conscience (Moon et al., 2001).
Ainsi, lorsque le chaton subi une hypoxie au cours de la mise-bas, la réponse fœtale se met en place et retarde le début de la respiration spontanée (Moon et al., 2001). Ceci peut être limité grâce à des stimulations tactiles et thermiques (Moon et al., 2001). Il est conseillé par certains auteurs de stimuler en particulier les régions ombilicale et génitale en cas d’hypoxie au cours des trois premiers jours de vie, afin de provoquer une respiration réflexe (Grundy, 2006).
Le signe caractéristique d’affection respiratoire chez le chaton nouveau-né est la dyspnée ou détresse respiratoire (Root Kustritz, 2011). La détresse respiratoire se manifeste par une fréquence, des efforts et/ou des bruits respiratoires augmentés ou un collapsus pulmonaire aigu (Root Kustritz, 2011). L’halètement est un signe de température augmentée normal chez le chien alors que chez le chaton, il est dans la majorité des cas associé à une détresse respiratoire significative. La respiration bouche ouverte est, elle, considérée comme pathologique chez le chiot et le chaton (Root Kustritz, 2011).
De par l’immaturité de l’appareil respiratoire, la réponse à l’hypoxie chez le chaton débute en général par une brève augmentation de la fréquence de ventilation puis, très rapidement, une diminution de celle-ci. Le traitement de l’hypoxie doit donc débuter avant que les muscles respiratoires ne montrent de signes de fatigue (Moon et al., 2001).
Système digestif
Les dents
Le chaton naît sans aucune dent (Hoskins, 1990).
Le tube digestif
A la naissance, la taille de l’estomac est petite proportionnellement au reste du corps. Par conséquent, la capacité d’ingestion est faible (environ 1mL pour 10g de poids corporel par jour la première semaine). C’est durant les premières heures de vie que le poids, la longueur et la surface de l’intestin grêle augmentent le plus (Zabielski et al, 1999).
La consommation du colostrum va agir comme un mécanisme déclencheur du développement de la paroi digestive. En effet, il apporte des facteurs de croissance qui favorisent l’acquisition, le développement et l’évolution de l’équipement enzymatique de la muqueuse intestinale (Zabielski et al, 1999). Les enzymes de la bordure en brosse des entérocytes permettent une digestion et absorption optimales. Leur activité augmente de façon marquée juste avant la mise-bas. C’est pourquoi les individus prématurés peuvent présenter des troubles digestifs (Peterson et Kutzler, 2011).
Notion de perméabilité de la barrière intestinale : dans les premières heures de vie, l’intestin est perméable aux macro-molécules telles que des hormones, des facteurs de croissance et autres peptides apportés par le colostrum de la mère (Zabielski et al, 1999). Ce transfert concerne également les agents de l’immunité essentiels au chaton, comme les immunoglobulines G (IgG).
À la naissance, le tube digestif du chaton est presque stérile (Peterson et Kutzler, 2011). Immédiatement après sa naissance, des bactéries de son environnement, de son alimentation et de sa mère s’y installent. La vitesse de colonisation est fonction de l’intensité des contacts du chaton avec les sources d’organismes colonisateurs (Smith, 1965).
Les premières bactéries à se développer dans le tube digestif du chaton nouveau-né sont des coliformes et des entérocoques (Smith, 1965).
Le rôle de la flore intestinale est crucial dans la protection de l’organisme contre la colonisation par des bactéries exogènes, potentiellement pathogènes. L’établissement d’un microbiote digestif chez le nouveau-né affecte le développement de son système immunitaire et, par conséquent, sa santé à long terme. Ainsi, toute perturbation de l’équilibre de la flore digestive augmente les risques de maladie pour le chaton (Gauclère, 1993).
- Digestion des protéines
Durant les premières heures de vie, l’absorption des protéines se fait via un transport non spécifique. En effet, il existe au niveau de l’intestin grêle un transport macromoléculaire non sélectif qui permet de transférer les immunoglobulines et autres protéines de la lumière intestinale dans la circulation sanguine sans les dégrader. Les immunoglobulines colostrales échappent aux processus de digestion enzymatique, encore immatures chez le nouveau-né, et sont absorbées intactes au niveau de l’intestin grêle. L’absorption des macromolécules chez le nouveau-né se fait en deux étapes : internalisation des macromolécules dans les cellules épithéliales par pinocytose et transport des macromolécules vers le sang. La pinocytose intestinale est un mécanisme non spécifique qui n’est présent que durant une courte période (Crawford et al, 2003).
Il existe également un transport sélectif qui consiste en l’endocytose des immunoglobulines après fixation à des récepteurs présents sur les entérocytes : les récepteurs FcγRn (Fragment cristallisable gamma Récepteur). Celui-ci transporte de manière sélective le fragment constant de l’IgG de la lumière intestinale à la circulation lymphatique sans dégradation (Buddington, 1996).
- Digestion des glucides
A la naissance, celle-ci est concentrée sur la digestion du lactose, qui fait partie des principales sources d’énergie du lait. Les autres oses de petite taille tels que saccharose, maltose, isomaltose peuvent également être digérés. En revanche, les oses à longue chaîne ne sont pas ou presque pas digérés (Harper et Turner, 2000).
- Digestion des lipides
La digestion des lipides du lait est possible grâce à la lipase. Cette enzyme est présente dans le suc gastrique et le lait ingéré, à la naissance. Elle agit en présence des sels biliaires et produit des micelles qui contiennent des acides gras, du glycérol et des monoglycérides, qui seront absorbés par simple diffusion. Les sels biliaires sont réabsorbés en grande partie au niveau de l’iléon et subissent le cycle entéro-hépatique (Reece, 1997).
La lipase pancréatique est peu sécrétée à la naissance (Peterson et Kutzler, 2011).
Tableau 4 : paramètres biochimiques de la fonction hépatique chez le chaton à la naissance (Von Dehn, 2014) et chez le chat adulte (Hébert, 2010).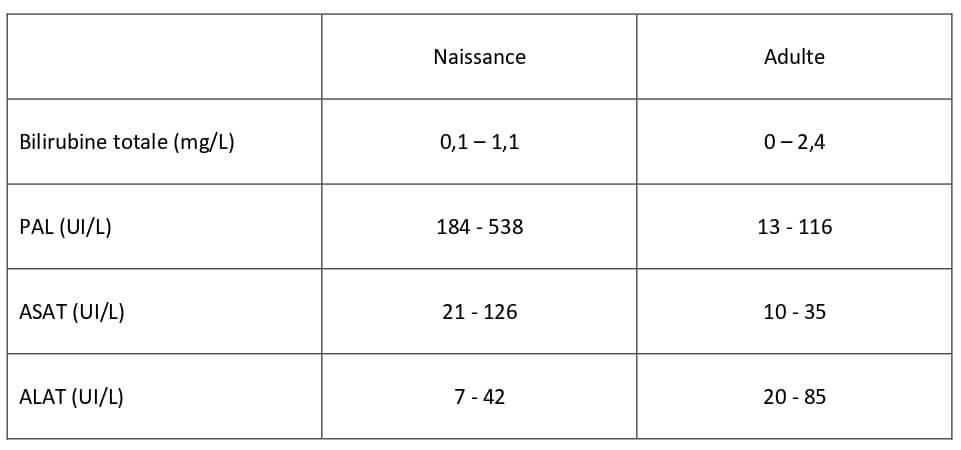
Système urinaire
- Filtration glomérulaire et réabsorption tubulaire
À la naissance, les reins du chaton sont immatures, tant au niveau structurel que fonctionnel.
Le débit de filtration glomérulaire du nouveau-né équivaut à 20 à 25 % de celui de l’adulte (proportionnellement au poids). Ceci est dû à une pression artérielle faible et un épithélium glomérulaire peu perméable (Fettman et Allen, 1991).
De même, la réabsorption tubulaire du chaton à la naissance est immature. La capacité de concentration des urines est donc peu développée : ces dernières ne sont qu’1,5 fois plus concentrées que le sang chez le chaton nouveau-né contre 4 à 5 fois chez le chat adulte ; sa densité urinaire est inférieure à 1,020 (Little, 2011). Conséquence d’une moindre réabsorption des molécules organiques par les tubules, les concentrations urinaires en protéines, glucose et acides aminés sont plus élevées chez le nouveau-né que chez l’adulte. Une glycosurie
physiologique est donc fréquente. De même, une protéinurie est observée du fait de l’absorption intestinale des protéines colostrales et de la perméabilité de l’épithélium glomérulaire. De même, la clairance rénale de la créatinine du chaton de moins de 2 mois est d’environ 1,39 à 3,59 mL/min/kg, contre 3,80 à 4,74 mL/min/kg chez le chaton de 9 à 19 semaines (Dial, 1992).
Le nouveau-né est également prédisposé à l’acidose métabolique. D’un côté, le métabolisme du chaton a un rythme deux fois plus élevé que celui de l’adulte, donc produit deux fois plus d’acides. De l’autre, la capacité d’excrétion urinaire des protons est faible (Lage, 1980, cité par Gauclere, 1993).
- Conséquences sur l’utilisation de médicaments en pratique
L’immaturité rénale est à prendre en compte lors de l’administration de médicaments excrétés ou métabolisés par les reins. En effet, leur clairance rénale est diminuée, ce qui peut induire des effets secondaires indésirables comme une néphrotoxicité ou une augmentation de leur durée d’action. C’est le cas notamment de la kétamine et de certains antibiotiques (céphalosporines, pénicillines, tétracyclines, trimétoprimes-sulfates) (Dial, 1992). L’antibiotique de choix cité par les auteurs est généralement le ceftiofur (2,5 mg/kg par voie sous-cutanée toutes les 12 h pendant un maximum de 5 jours). L’utilisation d’anti- inflammatoires non stéroïdiens chez le nouveau-né est déconseillée du fait de leur toxicité rénale accrue chez ce sujet (Grundy, 2006).
- Paramètres biochimiques de la fonction rénale
La créatininémie :
À la naissance, la concentration sanguine en créatinine est plus élevée qu’à l’âge adulte : entre 1,2 et 3,1 mg/dL de sang en moyenne (Tableau 5).
Tableau 5 : Créatininémie du chaton à la naissance (Levy et al., 2006) et du chat adulte (Hébert, 2005).
L’urémie :
L’urémie chez le chaton dépend de la durée du jeûne (temps écoulé entre le dernier repas et le prélèvement sanguin). A la naissance, elle est comprise entre 2,6 et 4,5 mg/dL (Tableau 6).
Tableau 6 : Urémie du chaton à la naissance (Levy et al., 2006) et du chat adulte (Hébert, 2005).
Les besoins hydriques du nouveau-né sont estimés à 120 à 180 mL par kg de poids corporel, donc plus importants que l’adulte (50 à 100 mL/kg). Ceci est dû à une plus forte teneur en eau dans son organisme (80 % contre 60 % pour le chat adulte), un rapport surface sur poids corporel plus important, un métabolisme plus rapide et une masse graisseuse plus faible.
Le chaton nouveau-né est sujet à une déshydratation rapide (Fettman et Allen, 1991), mais celle-ci est difficile à évaluer cliniquement. Le test du pli de peau n’est pas significatif, puisque la peau du chaton contient moins de graisse et plus d’eau que celle du chat adulte. L’humidité des muqueuses est facilement évaluable et est un reflet de l’état d’hydratation (Moon et al., 2001).
À la naissance, le chaton n’urine pas seul, une stimulation de la zone périanale par la mère est nécessaire. La première miction a lieu dans les 24 heures suivant la naissance (Moon et al., 2001).
Comportement
Comportement alimentaire
À la naissance, le chaton se nourrit du lait maternel. Le comportement de tétée est présent dès la naissance, il est permis par une addition de réflexes. Il est indépendant de l’apprentissage et de l’expérience (Kovach et Kling, 1967).
Suite à la naissance des chatons, la chatte se couche et adopte une posture favorable à l’allaitement. Les chatons doivent alors trouver par eux-mêmes les tétines. Ils commencent à téter quelques minutes après s’être accrochés, puis s’arrêtent au bout d’environ 20 secondes. Le chaton s’accroche à n’importe laquelle des tétines à la naissance. Après quelques heures, ils utilisent préférentiellement les tétines postérieures (Bradshaw et al., 2012). Le chaton nouveau-né tête toutes les 2 à 4 heures, chaque tétée pouvant durer jusqu’à 45 minutes, pour un total d’environ 8 heures par jour. Une grande partie de ce temps n’implique pas l’ingestion de lait, ce sont des phases de tétées « non nutritives », qui peuvent représenter 90 % d’une séance d’allaitement (Beaver, 1992).
À ce stade, le sommeil profond ne présente pas toutes les caractéristiques qu’il présente chez l’adulte (activité cérébrale lente, respiration régulière, mouvements des yeux lents et tonus musculaire modéré) (Hoppenbrouwers et Sterman, 1975). On observe ainsi souvent un sommeil agité, avec des contractions rapides des muscles de la face, des oreilles et des mouvements des paupières, des membres et du corps, et même parfois des vocalises : c’est le sommeil paradoxal. De plus, le sommeil de groupe (les chatons dorment ensemble regroupés) est marqué à cette période (Gauclère, 1993). Le chaton nouveau-né dort plus de 20 heures par jour selon Gauclère (1993), et au moins 50 % du temps selon Beaver (1992).
Le jeu a plusieurs intérêts. Il permet un entraînement physique musculaire mais aussi l’amélioration de la coordination et de l’équilibre. De plus, le jeu assure l’exploration de l’environnement et développe des contacts sociaux entre congénères. On distingue différents types de jeux : jeux sociaux (impliquant un autre chat), jeux avec des objets, jeux de prédation.
Chez le chaton à la naissance, aucun des trois n’est encore développé (West, 1974 ; Martin et Bateson, 1985).
On distingue différents types de vocalises, émises dans des situations différentes : le ronronnement, le murmure, les miaulements, le hurlement, le grognement, le feulement, le sifflement, le crachement, le cri de douleur et le claquement de dents. Chaque vocalisation est émise dans un contexte particulier. La fréquence, la durée ainsi que l’amplitude varient suivant les situations et l’âge des chatons. Le grognement est présent à la naissance, tandis que le ronronnement est, lui, absent (Beaver, 1992).
Système neurologique
Capacités sensorielles
- Vision
Les yeux des chatons sont fermés à la naissance. Le chaton est alors incapable de voir.
Les réflexes liés à la vision sont décrits dans la partie « Réflexes liés à la vision ».
- Audition
Le canal auditif est fermé à la naissance. Il s’ouvre progressivement de l’extérieur vers l’intérieur. Par contre, les pavillons auriculaires sont capables de s’orienter vers des stimuli autres qu’auditifs (olfactifs, tactiles, visuels). Ces réactions ne sont cependant pas encore matures (Olmstead et Villablanca, 1980).
- Olfaction
L’olfaction est présente à la naissance. Elle permet de trouver les mamelles (Beaver, 1980).
- Goût et toucher
Le toucher et le goût sont développés au cours de la gestation et donc présents à la naissance (Bradshaw et al., 2012).
À la naissance, les chatons sont sensibles aux températures extérieures mais quasiment incapables de réguler leur température corporelle (Bradshaw et al., 2012). En réalité, la vasodilatation et la vasoconstriction sont déjà effectives à cet âge, mais leurs capacités sont rapidement dépassées. La température corporelle est de mieux en mieux contrôlée grâce au développement du frisson thermique et du halètement en tant que mécanismes de thermogenèse d’une part et de thermolyse d’autre part (Olmstead et al., 1979). En effet, le chaton est capable d’haleter à une fréquence déjà élevée à la naissance (Olmstead et al., 1979). Ceci lui permet d’évacuer un surplus de chaleur.
À la naissance, les chatons restent dans le nid et n’en sortent pas. Leur température reste ainsi relativement stable (Olmstead et al., 1979).
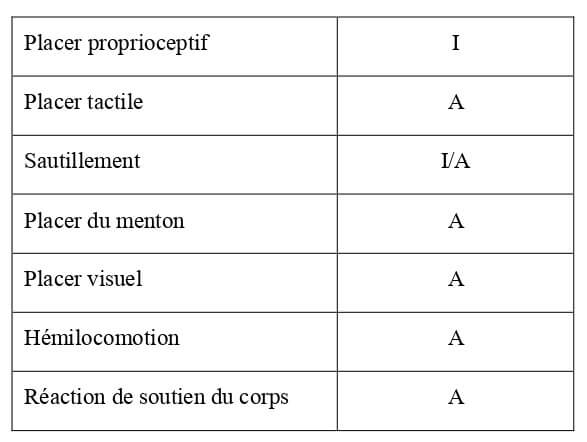
Ce sont des actions volontaires déclenchées qui nécessitent une coordination entre le système sensoriel, la moelle spinale et les motoneurones centraux et périphériques. Leur évaluation permet d’apprécier la symétrie de développement des fonctions neurologiques chez le chaton. Leur présence ou non chez le chaton à la naissance est reportée dans le Tableau 7.
Tableau 7 : Bilan des réactions posturales chez le chaton à la naissance (Villablanca et Olmstead, 1979 ; Sechzer et al., 1984 ; Hoskins, 1990). M = réaction mature ; I = réaction immature ou en cours de maturation ; A = réaction absente.
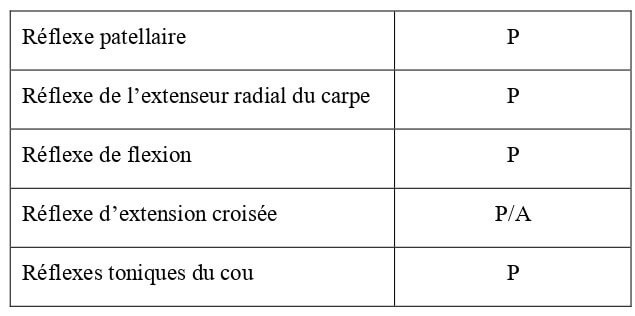
Il s’agit de réactions involontaires déclenchées artificiellement. Un réflexe diminué (hyporéflexie) ou absent (aréflexie) indique une anomalie des fibres sensitives segmentaires et/ou des motoneurones périphériques. Un réflexe augmenté (hyperréflexie) peut montrer une anomalie au niveau des motoneurones centraux. L’évaluation des réflexes sur un chaton est compliquée, de par une hétérogénéité des individus dans leur développement et une difficulté de mise en évidence (Hoskins, 1990). Leur présence ou non chez le chaton à la naissance est reportée dans le Tableau 8.
Tableau 8 : Bilan des réflexes moteurs chez le chaton à la naissance (Hoskins, 1990). P = réflexe présent ; A = réflexe absent.
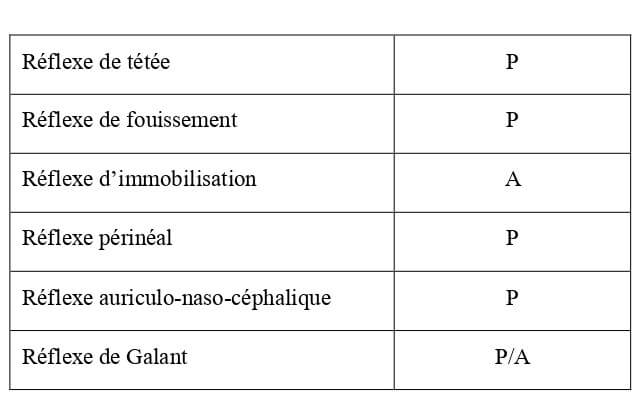
Les indices tactiles semblent avoir moins d’importance que les indices olfactifs. En effet, les réflexes tactiles (Tableau 9) sont peu développés alors que l’odorat est, lui, très développé à la naissance. Ce dernier est essentiel notamment dans la recherche des mamelles (Beaver, 1980).
Tableau 9 : Bilan des réflexes liés à une stimulation tactile chez le chaton à la naissance (DeGroat et al., 1975 ; Beaver, 1980 ; Gagnon, 2012 ; Bradshaw et al., 2012). P = réflexe présent ; A = réflexe absent.
Réflexes liés à la vision
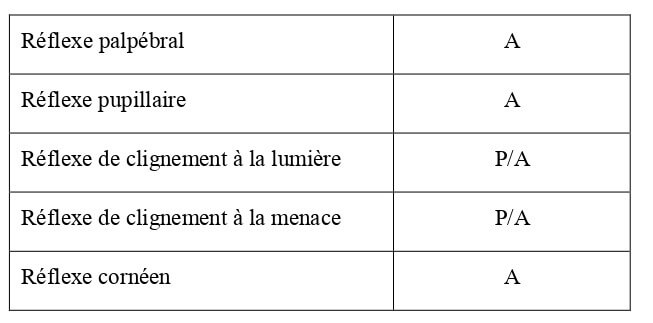
Les réflexes liés à la vision sont reportés dans le Tableau 10.
Tableau 10 : Bilan des réflexes liés à la vision chez le chaton à la naissance (Villablanca et Olmstead, 1979 ; Beaver, 1980). P = réflexe présent ; A = réflexe absent.
À la naissance, le chaton se déplace par reptation uniquement. Ses membres antérieurs sont plus forts que les postérieurs, mais aucun n’est capable de soutenir le corps. Il se déplace très peu et uniquement sur de courtes distances (Bradshaw et al., 2012).
Les déplacements sont dirigés par plusieurs sens et réflexes : le toucher, le thermotactisme et l’olfaction (phéromones libérées par les glandes mammaires et les apaisines libérées par le sillon intermammaire).
Sang
Volémie
Le volume sanguin total du chaton est de 5 à 10 mL/100 g de poids corporel, équivalent à celui du chat adulte (Von Dehn, 2014).
- Lignée rouge
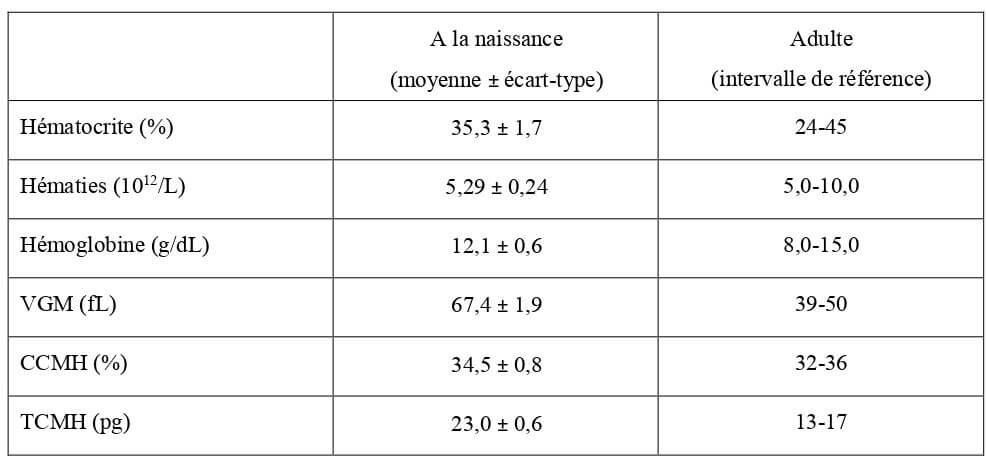
L’hématie du nouveau-né est sensiblement différente de celle du chat adulte. Tout d’abord, elle présente une macrocytose. En effet, son volume globulaire moyen (VGM) est plus élevé que celui de l’adulte (Tableau 11). De plus, elle est produite en plus faible quantité et présente une durée de vie plus courte que celle du chat adulte (66 à 79 jours chez le chaton contre 85 à 90 jours chez le chat adulte (Gauclère, 1993)). Ceci peut être à l’origine d’un dénombrement important de réticulocytes, de corps d’Howell-Jolly et de corps de Heinz lors de la réalisation d’une cytologie sanguine (Von Dehn, 2014).
L’hématocrite du nouveau-né est élevé par rapport aux valeurs usuelles de l’adulte (Tableau 11), d’où le fait qu’il présente une hyperhémie des muqueuses (Von Dehn, 2014).
Les paramètres sanguins relatifs aux hématies chez le chaton à la naissance (hématocrite, hémoglobinémie, VGM, CCMH, TCMH et nombre d’hématies) sont reportés dans le Tableau 11.
L’hémoglobine est de structure identique à celle de l’adulte et possède une affinité semblable au dioxygène (Wellman, 2010).
Tableau 11 : Valeurs hématologiques moyennes de la lignée rouge chez le chaton à la naissance en bonne santé (Grundy, 2006) et chez l’adulte (Hébert, 2010). VGM : volume globulaire moyen ; CCMH : concentration corpusculaire moyenne en hémoglobine ; TCMH : teneur corpusculaire moyenne en hémoglobine.
- La lignée blanche
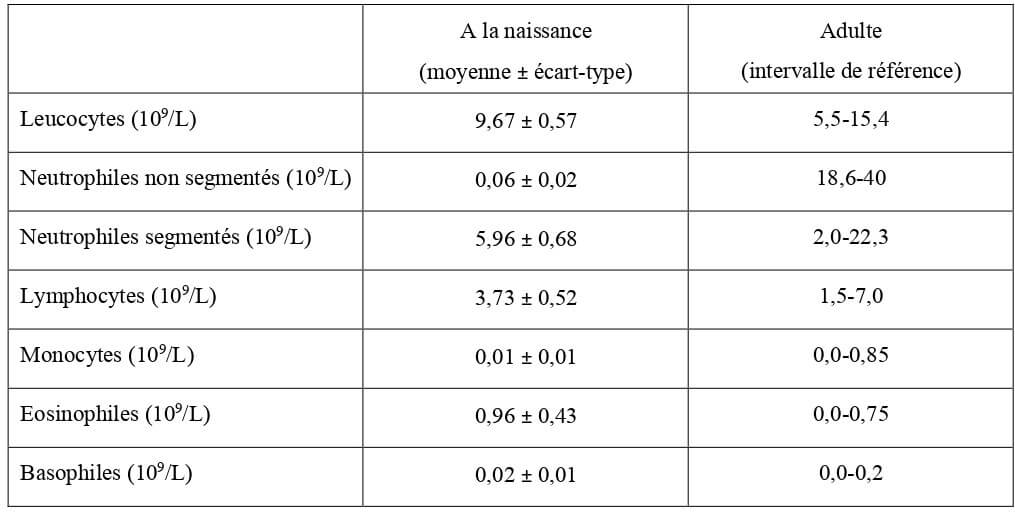
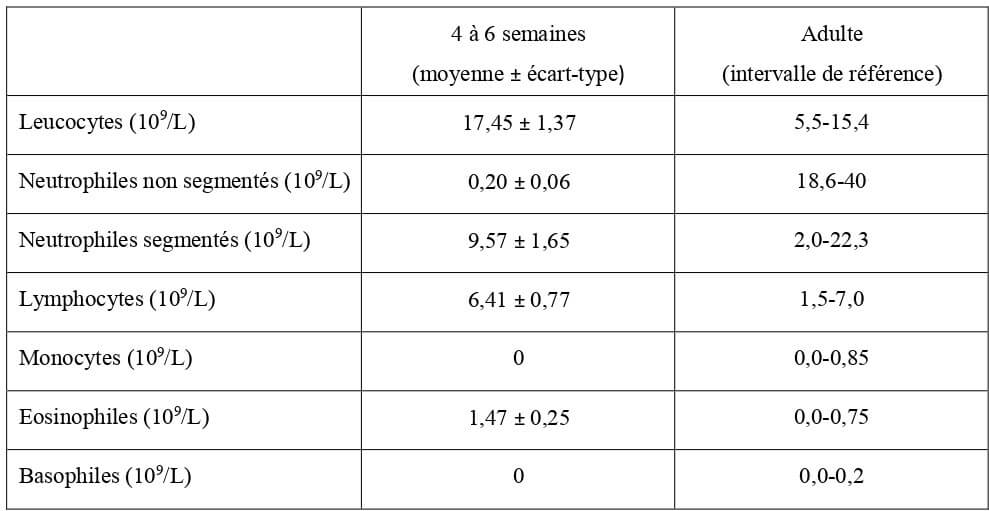
Les concentrations sanguines en leucocytes, granulocytes neutrophiles et lymphocytes chez le chaton sont dans les intervalles de référence de l’adulte à la naissance. Le taux de granulocytes éosinophiles est légèrement supérieur aux normes adultes (Tableau 12).
Tableau 12 : Valeurs hématologiques moyennes de la lignée blanche chez le chaton à la naissance en bonne santé (Grundy, 2006) et chez l’adulte (Hébert, 2010).
- Les protéines plasmatiques
Albumine :
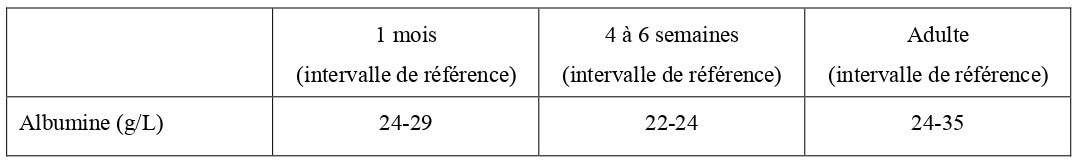
À la naissance, la concentration en albumine plasmatique est plus faible qu’à l’âge adulte (Tableau 13).
Tableau 13 : Concentration sanguine en albumine chez le chaton à la naissance (Levy et al., 2006 ; Von Dehn, 2014) et chez le chat adulte (Hébert, 2010).
Concentration sanguine en albumine chez le chaton à la naissance
Protéines totales :
À la naissance, la concentration sérique en protéines totales est plus faible qu’à l’âge adulte chez le chaton (Tableau 14).
Tableau 14 : Concentration sanguine en protéines totales chez le chaton à la naissance (Levy et al., 2006 ; Von Dehn, 2014) et chez le chat adulte (Hébert, 2010).
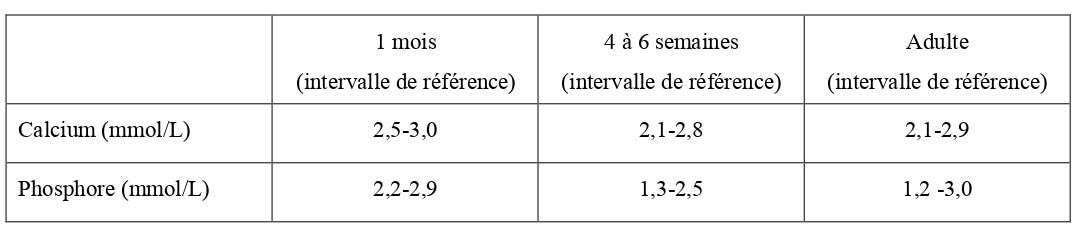
Bien que le calcium et le phosphore soient essentiels pour la croissance des os, ils le sont également pour assurer une stabilité cellulaire, la contraction musculaire et la régulation acido-basique. Ces deux minéraux sont présents en grande quantité dans le sang du chaton à la naissance (Tableau 15).
Tableau 15 : Concentrations sanguines en calcium et en phosphore chez le chaton à la naissance (Levy et al., 2006 ; Von Dehn, 2014) et chez le chat à l’âge adulte (Hébert, 2010).
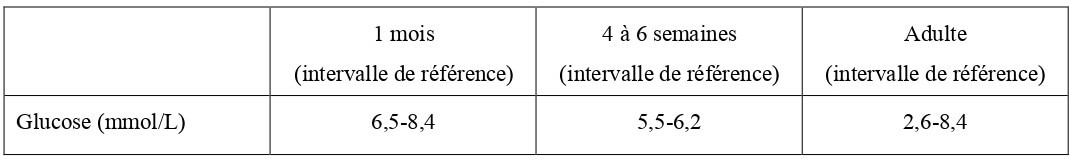
Le glucose sanguin est régulé par trois mécanismes majeurs : l’absorption intestinale, la production hépatique et, à un plus faible degré, la production rénale. Chez le chaton nouveau-né, qui présentent notamment une fonction hépatique immature, le potentiel de néoglucogenèse et de glycogénolyse est faible. Par conséquent, la plus grande part de la concentration plasmatique en glucose chez le chaton provient des apports alimentaires. C’est pourquoi le chaton est particulièrement sujet à l’hypoglycémie en cas de stress, maladie, ou toute autre raison entrainant une réduction de l’absorption intestinale de glucose ou un jeûne (Gorman, 2011). La glycémie du chaton le jour de sa naissance est reportée dans le Tableau 16.
Tableau 16 : Concentration sanguine en glucose chez le chaton à la naissance (Levy et al., 2006 ; Von Dehn, 2014) et chez le chat adulte (Hébert, 2010).
La cholestérolémie et la triglycéridémie sont régies par la production hépatique de cholestérol et par l’absorption intestinale de lipides. Le chaton nouveau-né présente une fonction hépatique immature. Cependant, il se nourrit exclusivement de lait, très riche en lipides (Gorman, 2011). A la naissance, la cholestérolémie et la triglycéridémie restent semblables aux normes de l’adulte chez le chat (Tableau 17).
Tableau 17 : Concentrations sanguines en cholestérol et en triglycérides chez le chaton à la naissance (Levy et al., 2006 ; Von Dehn, 2014) et chez le chat adulte (Hébert, 2010).
La CK (Créatinine Kinase) est une enzyme qui signe une détérioration cellulaire du myocarde ou une rhabdomyolyse. Sa valeur à la naissance est très élevée par rapport aux valeurs de l’adulte, du fait du traumatisme subi au moment de la mise-bas par le chaton (Tableau 18).
Tableau 18 : Concentration sanguine en créatinine kinase chez le chaton à la naissance (Levy et al., 2006 ; Von Dehn, 2014) et chez le chat adulte (Hébert, 2010). CK : Créatine Kinase.
Voir système urinaire.
Système immunitaire
Organes hématopoïétiques
La plupart des cellules du système immunitaire sont d’origine hématopoïétique. A la naissance, la moelle osseuse, la rate, le foie, les nœuds lymphatiques et le thymus sont déjà engagés dans l’hématopoïèse. Celle-ci se poursuit tout au long de la vie dans la moelle osseuse après la naissance. Elle persiste à la naissance dans le foie et la rate. Le thymus est le siège de la différenciation et maturation des lymphocytes T.
Réponse immunitaire
À la naissance, le système immunitaire du chaton est fonctionnel mais totalement naïf, n’ayant été soumis qu’à des sollicitations antigéniques faibles. Dépourvu de cellules mémoires, le nouveau-né élabore une réponse de type primaire, d’intensité plus modérée et plus lente à se mettre en place qu’une réponse secondaire. Il est également déficitaire en éléments de l’immunité spécifique (leucocytes, enzymes, facteurs du complément) (Tizard, 2009).
De plus, l’efficacité de l’immunité non spécifique est même encore diminuée par les conditions spécifiques de la naissance : l’imprégnation hormonale du nouveau-né au moment du part par des glucocorticoïdes et des prostaglandines PGF2α aux propriétés immunosuppressives peut entraîner une baisse des fonctions des cellules phagocytaires (granulocytes et des macrophages).
Concernant l’immunité spécifique, les lymphocytes B, assurant l’immunité à médiation humorale, se développent d’abord dans le foie fœtal puis dans la moelle osseuse. Ils sont ensuite distribués dans les tissus lymphoïdes secondaires, et notamment les nœuds lymphatiques et la rate. La prolifération de lymphocytes T, assurant l’immunité à médiation cellulaire, est faible à la naissance. Ceci pourrait expliquer en partie la fragilité des chatons face aux affections bactériennes (Person, 2003).
Si on vaccine un chaton avant la prise colostrale, il est toutefois incapable de produire une réponse immunitaire le jour de sa naissance du fait de l’immaturité de son système immunitaire. Après la prise colostrale, l’interférence vaccinale rend inutile l’injection.
Jour 0 à Jour 10

Croissance
- Calcul du poids idéal grâce au gain moyen quotidien :
La croissance d’un individu est reflétée par son gain moyen quotidien, exprimé en grammes par jour. Il est calculé comme suit :
GMQJa-Jb = (PJb –PJa) / (a–b)
Cet indice peut être exprimé en pourcentage du poids au jour a (Ja). Entre 0 et 10 jours de vie, l’objectif de croissance est de 5 à 10 % de poids de naissance par jour (Greco et Watters, 1990), ou au moins 7 à 10 grammes par jour (Kirk et al., 2000). Ces deux modes de calcul aboutissent à des valeurs équivalentes.
Ainsi, à l’âge de 10 jours, le chaton dont le poids de naissance varie entre 85 et 120 grammes devrait peser au moins 155 à 220g selon Kirk et al., ou entre 127 et 180g selon Greco et Watters.
- Calcul du poids idéal grâce au gain moyen hebdomadaire :
Il existe également un autre indice reflétant la croissance à plus grande échelle : le gain moyen hebdomadaire (en grammes par semaine). Il est calculé comme suit :
GMH = Pt+1semaine–Pt
La littérature fournit des objectifs sensiblement différents selon les auteurs. Le chaton doit prendre 100g par semaine (Greco et Watters, 1990 ; Kirk et al., 2000), ou entre 50 et 100g par semaine (Peterson, 2011).
Ainsi, le chaton d’une semaine devrait peser entre 185 et 220g (Greco et Watters, 1990 ; Kirk et al., 2000).
- Calcul du poids idéal grâce aux facteurs de multiplication du poids :
Le poids du chaton devrait être multiplié par deux à 8 à 10 jours d’âge (Peterson, 2011), ou au bout de 2 semaines (Greco et Watters, 1990), voire à l’âge de 10-14 jours (Root Kustritz, 2011).
- Courbe de croissance :
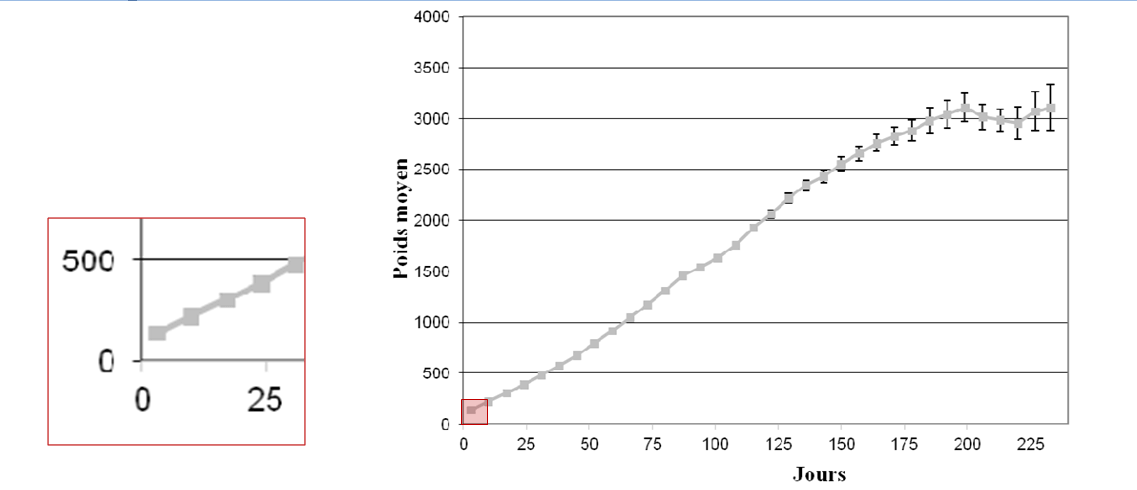
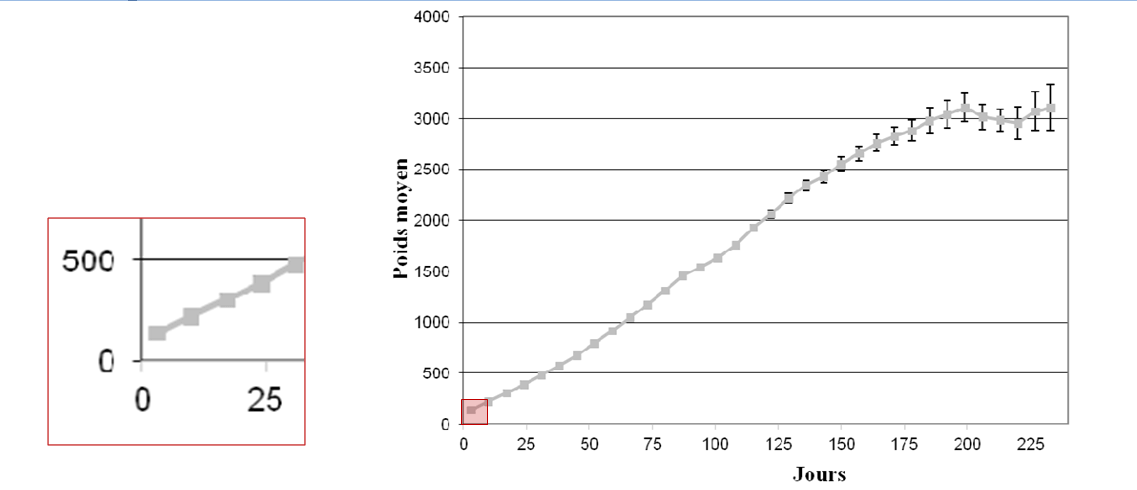
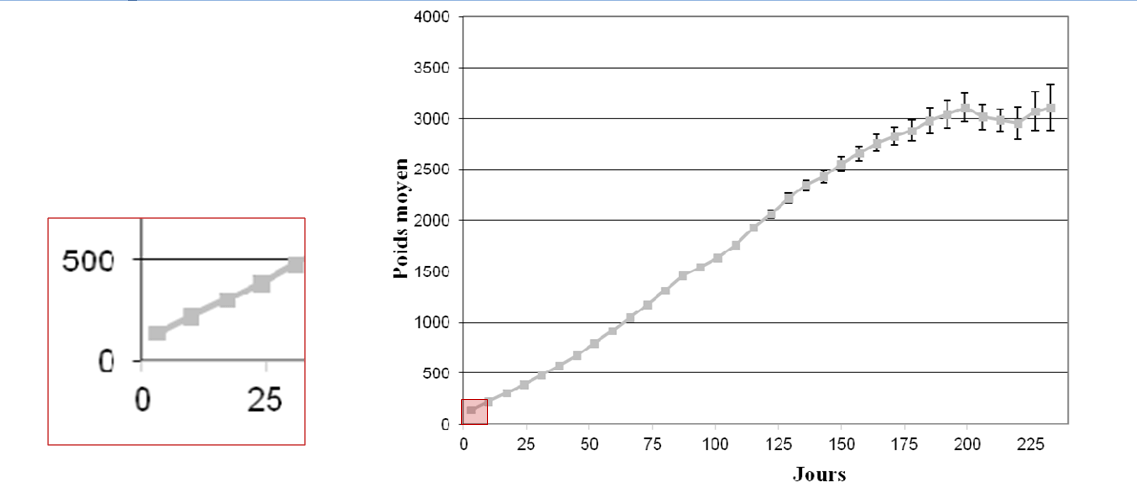
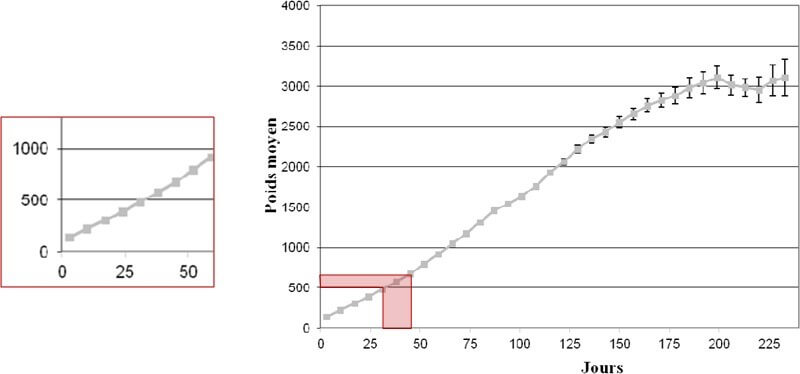
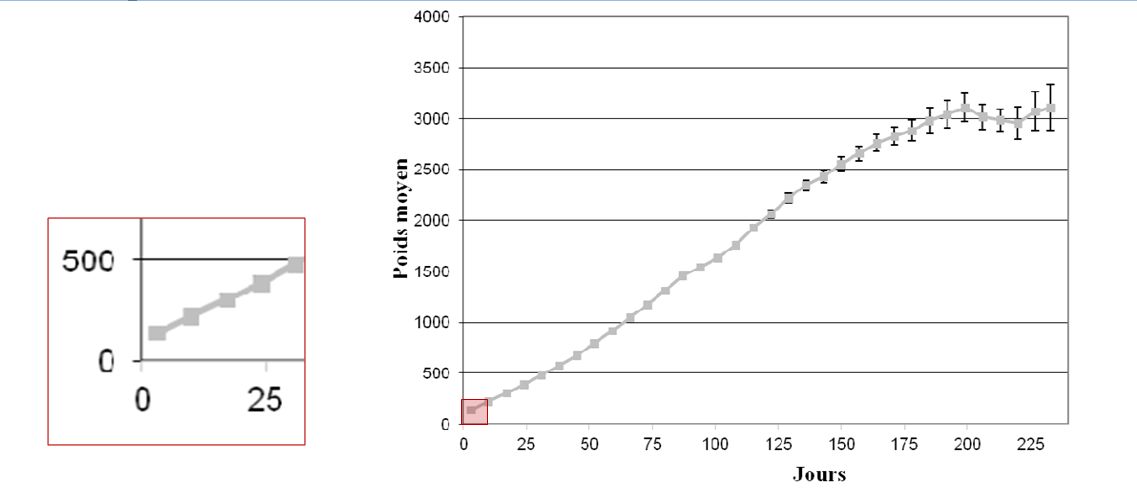
La littérature fournit des objectifs de croissance. Gast a réalisé une courbe de croissance sur 370 chatons en bonne santé (Figure 2), nous permettant de visualiser l’allure de celle-ci entre 0 et 10 jours de vie. Néanmoins, la croissance du chaton au cours des 10 premiers jours de vie varie en fonction du sexe, de la taille de la portée, du poids de naissance (un chaton de faible poids de naissance garde sur cette période un poids inférieur à celui des chatons nés avec un poids normal) (Gast, 2011).
Figure1: Poids moyen (avec IC 95%) des chatons « en bonne santé » au cours de la croissance et grossissement sur la période entre 0 et 10 jours de vie (Gast, 2011).
Système cardio-vasculaire
Anatomie cardio-vasculaire
Les phénomènes survenant au moment du part sont décrits dans la partie « A la naissance ».
La portion externe du cordon ombilical coupé à la naissance va sécher et tomber aux alentours de 3 jours après la naissance (Grellet, 2010).
Durant les 10 premiers jours de vie, la masse du ventricule droit est stable, alors que le ventricule gauche voit sa masse augmenter de façon linéaire (Bishop, 1999).
Fonction cardiaque
- Auscultation
Fréquence et rythme cardiaques
L’auscultation du cœur est difficile du fait de la taille du thorax et de la fréquence cardiaque élevée. Elle doit se réaliser à gauche, au niveau de l’apex cardiaque, entre le 5ème et le 6ème espace intercostal, dans le tiers ventral du thorax. L’usage d’un stéthoscope pédiatrique est conseillé (Root Kustritz, 2011).
La fréquence cardiaque normale d’un chaton de moins de 10 jours est d’environ 240 ± 20 battements par minute (bpm) (Lourenço et Ferreira, 2003).
Le rythme cardiaque est un rythme cardiaque sinusal régulier chez le chaton de 0 à 10 jours.
Souffles physiologiques
Des souffles cardiaques de grades 1/6 à 3/6 entendus chez les chatons de 0 à 10 jours sont le plus souvent causés par le flux sanguin aortique ou pulmonaire rapide ou des délais variables de fermeture des shunts intracardiaques ou entre le cœur et les grands vaisseaux (Root Kustritz, 2011). Les souffles de grades 4/6 à 6/6 sont généralement dus à des malformations cardiaques congénitales. Les plus fréquentes chez le chat sont la dysplasie de la valve tricuspide et l’aplasie du septum ventriculaire (Root Kustritz, 2011).
D’autre part, durant les 4 premiers jours de vie, en cas d’hypoxie, la fréquence cardiaque diminue, ce qui est la réponse contraire à celle rencontrée chez un chat adulte (Grundy, 2006). Le flux sanguin est alors redistribué de façon à favoriser le cœur, le diaphragme, le cerveau et les glandes surrénales, aux dépens de la rate, du tractus intestinal, de la peau et des reins (Moon et al., 2001).
- Electrocardiogramme
L’électrocardiographie (ECG) est rarement réalisée sur des chatons de cet âge mais permettrait de détecter des arythmies ou des défauts de conduction. L’onde P présente une amplitude et durée semblables à celles de l’adulte. La durée et l’amplitude du complexe QRS et des intervalles PR et QT le sont également. On observe à cette période une augmentation progressive de la durée de l’onde R, jusqu’à atteindre les valeurs du chat adulte (Lourenço et Ferreira, 2003).
- Pression artérielle
La pression artérielle du chaton de moins de 10 jours est comprise entre 40 à 50 mmHg. Ces faibles valeurs sont dues aux parois musculaires artérielles immatures et à une faible résistance artérielle périphérique. Chez le chaton de moins de 10 jours, l’analyse des variations de la pression sanguine ne permet pas de diagnostiquer un choc hypovolémique (Giry, 2002).
- Adaptabilité cardiaque
Le chaton de moins de 10 jours présente un débit cardiaque, un volume plasmatique, une pression veineuse centrale et une post-charge plus élevés que chez l’adulte. Au contraire, la pression artérielle moyenne, le volume d’éjection systolique, la résistance vasculaire périphérique et la précharge sont plus faibles (McIntosh Bright et Holmberg, 1990). La masse myocardique contractile et la compliance ventriculaire (capacité des ventricules à se dilater) sont également plus faibles. Ainsi, la réserve cardiaque est faible et le volume d’éjection systolique ne varie pas (Giry, 2002). Le débit cardiaque du chaton (DC = VESxFC avec DC : Débit cardiaque (L/min) ; VES : Volume d’éjection systolique (L) ; FC : Fréquence cardiaque (bpm)) ne dépend donc que de la fréquence cardiaque (McIntosh Bright et Holmberg, 1990).
De ce fait, le cœur du chaton a une très faible capacité d’adaptation en fonction des évènements (repos/exercice). De plus, le contrôle nerveux de la fréquence cardiaque est mauvais chez le chaton de 0 à 10 jours. Leur myocarde est moins dense en fibres sympathiques. Jusque là, le cœur du chaton est incapable notamment de répondre à une hypovolémie par une tachycardie. Ainsi, le chaton est sensible aux pertes sanguines, même peu importantes (5-10mL/kg). Ceci est à prendre en compte lors de prélèvements sanguins notamment (ils ne doivent pas excéder 0,5mL pour 100g de poids corporel) (McIntosh Bright et Holmberg, 1990).
Système respiratoire
Anatomie et physiologie de l’arbre respiratoire
Le nouveau-né possède des particularités anatomiques qui rendent son appareil respiratoire moins efficace que celui d’un adulte (Giry, 2002). La croissance des alvéoles et la formation de nouvelles bronchioles se poursuivent durant les premiers jours de vie (Root Kustritz, 2011). Ses voies respiratoires sont souples et de petit diamètre, avec une résistance à l’écoulement de l’air plus importante que chez l’adulte, et par conséquent un effort respiratoire plus intense. De plus, les risques d’obstruction sont plus élevés (Giry, 2002). La cage thoracique du chaton est encore souple et sa capacité résiduelle fonctionnelle est plus faible que chez l’adulte. En conséquence, la fermeture des voies aériennes périphériques, et donc le maintien d’une pression intra-thoracique négative, sont rendues plus difficiles (Giry, 2002).
Par ailleurs, l’appareil respiratoire du chaton est très sensible à la température de l’air, à sa teneur en oxygène, à ses composants toxiques ou irritants et aux agents infectieux qu’il contient (Grundy, 2006).
D’autre part, le chaton de 0 à 10 jours a des besoins en oxygène deux à trois fois plus élevés que l’adulte (Voldoire, 2002). C’est pourquoi il a une fréquence respiratoire plus élevée que le chat adulte : entre 10 et 18 mouvements par minutes la première semaine et entre 16 et 36 mpm la deuxième semaine (Little, 2011). Ce besoin important en oxygène peut être expliqué par plusieurs particularités : la taille importante de la langue par rapport à la cavité buccale (qui restreint le passage de l’air) (Voldoire, 2002) et le volume courant, inférieur à celui de l’adulte (Moon et al., 2001). L’amplitude respiratoire est également plus faible (Root Kustritz, 2011).
Le chaton nouveau-né se voit donc forcé de fournir un effort respiratoire supérieur à celui de l’adulte, alors que sa résistance à la fatigue musculaire est réduite (Moon et al., 2001). Tout ceci doit être pris en compte lors de l’examen clinique de la fonction respiratoire.
Réponse physiologique face à l’hypoxie
Face à l’hypoxie, l’organisme du chaton réagit, au cours des deux premiers jours de vie, de façon opposée à celui de l’adulte. En effet, il répond par une bradycardie et bradypnée avec une baisse du niveau de conscience. A partir de 24 à 48h, il y a une transition vers une réponse semblable à celle de l’adulte (Moon et al., 2001).
Ainsi, lorsque le chaton a subi une hypoxie au cours de la mise-bas, la réponse fœtale se met en place et retarde le début de la respiration spontanée (Moon et al., 2001). Ceci peut être limité grâce à des stimulations tactiles et thermiques (Moon et al., 2001). Il est conseillé par certains auteurs de stimuler en particulier les régions ombilicale et génitale en cas d’hypoxie au cours des 3 premiers jours de vie, afin de provoquer une respiration réflexe (Grundy, 2006).
Le signe caractéristique d’affection respiratoire chez le chaton nouveau-né est la dyspnée ou détresse respiratoire. La détresse respiratoire se manifeste par une fréquence, des efforts et/ou des bruits respiratoires augmentés ou un collapsus pulmonaire aigu (Root Kustritz, 2011). De plus, l’halètement est un signe de température augmentée normal chez le chien alors que chez le chaton, il est dans la majorité des cas associé à une détresse respiratoire significative. La respiration bouche ouverte est, elle, considérée comme pathologique chez le chiot et le chaton (Root Kustritz, 2011).
De par l’immaturité de l’appareil respiratoire, la réponse à l’hypoxie chez le chaton débute en général par une brève augmentation de la fréquence de ventilation puis, très rapidement, une diminution de celle-ci. Le traitement de l’hypoxie doit donc débuter avant que les muscles respiratoires ne montrent de signes de fatigue (Moon et al., 2001).
Système digestif
La longueur, le diamètre et le poids des organes du système digestif augmentent de façon importante les premiers jours de vie. A la fin de la première semaine, la vitesse de développement du tractus ralentit (Zabielski et al., 1999).
Durant les 10 premiers jours, la capacité d’ingestion du chaton augmente : de 1 à 1.5mL pour 10g de poids vif par jour. C’est durant les premières heures de vie que le poids, la longueur et la surface de l’intestin grêle augmentent le plus (Zabielski et al., 1999).
La consommation du colostrum agit comme un mécanisme déclencheur du développement de la paroi digestive. En effet, il apporte des facteurs de croissance qui favorisent l’acquisition, le développement et l’évolution de l’équipement enzymatique de la muqueuse intestinale. Durant les premières heures et premiers jours, la muqueuse gastrique subit ainsi une croissance intensive associée à une augmentation de la synthèse d’ADN et une diminution du renouvellement cellulaire. Elle se développe à la fois par hyperplasie et hypertrophie cellulaires. Elle commence à sécréter de l’acide chlorhydrique et des enzymes, provoquant une baisse rapide du pH luminal et parallèlement l’activation de la digestion protéique (Zabielski et al., 1999). Les enzymes de la bordure en brosse des entérocytes permettent une digestion et absorption optimales. Leur activité augmente de façon marquée juste avant la mise-bas. C’est pourquoi les individus prématurés peuvent présenter des troubles digestifs (Peterson et Kutzler, 2011).
Notion de fermeture de la barrière intestinale :
Dans les premières heures de vie, l’intestin est perméable aux macro-molécules telles que des hormones, des facteurs de croissance et autres peptides apportés par le colostrum de la mère (Zabielski et al., 1999). Ce transfert concerne également les agents de l’immunité essentiels au chaton, comme les IgG. La fermeture de la barrière intestinale correspond à l’arrêt du transport des macromolécules de l’intestin vers le sang. Les mécanismes qui y aboutissent sont mal connus, plusieurs hypothèses sont défendues dans la littérature. Par exemple, certaines hypothèses sont fondées sur le renouvellement normal de l’épithélium : après la naissance, les divisions des cellules de l’épithélium intestinal s’intensifient et les nouvelles cellules, plus matures, remplacent les cellules capables de pinocytose des immunoglobulines et de synthèse du récepteur FcγRn (Poffenbarger et al., 1991). D’autres hypothèses défendent que la perte de la perméabilité intestinale est due à une modification des propriétés des entérocytes déjà existants (Buddington, 1996). Après 12 heures d’âge, la barrière intestinale devient quasi imperméable aux IgG (plus que 10%), elle semble totalement hermétique au bout de 16h de vie (Casal et al., 1996). Débute alors le développement de la fonction digestive de l’intestin. La fermeture de la barrière intestinale permettrait également de protéger l’organisme contre des agents pathogènes qui pourraient être absorbés via des mécanismes d’absorption non sélective.
Immédiatement après la naissance, des bactéries de l’environnement, de l’alimentation et de la mère s’installent dans le tube digestif du chaton. La vitesse de colonisation est fonction de l’intensité des contacts du chaton avec les sources d’organismes colonisateurs (Smith, 1965).
Les premières bactéries à se développer dans le tube digestif du chaton nouveau-né sont des coliformes et des entérocoques. Les germes anaérobies colonisent au bout de quelques jours de vie le tube digestif, accompagnés des lactobacilles et des clostridies. Au bout de quelques jours, la nature des bactéries de la flore digestive est semblable à celle de l’adulte (Smith, 1965).
Le rôle de la flore intestinale est crucial dans la protection de l’organisme contre la colonisation par des bactéries exogènes, potentiellement pathogènes et dans le développement de son système immunitaire et, par conséquent, sa santé à long terme. Pour cela, plusieurs mécanismes sont mis en jeu : compétition pour le même substrat, compétition pour les sites d’attachement sur la muqueuse, production de facteurs environnementaux (pH, potentiel oxydo-réducteur, production de métabolites toxiques et de sulfure d’hydrogène), élaboration de substances antibactériennes (bactériocines), stimulation et régulation de l’immunité locale et systémique et développement des tissus lymphoïdes (Plaques de Peyer) (Lecoindre, 2010). Ainsi, toute perturbation de l’équilibre de la flore digestive augmente les risques de maladie pour le chaton (Gauclère, 1993).
- Digestion des protéines
Durant les premières heures de vie, l’absorption des protéines se fait via un transport non spécifique. En effet, il existe au niveau de l’intestin grêle un transport macromoléculaire non sélectif qui permet de transférer les immunoglobulines et autres protéines de la lumière intestinale dans la circulation sanguine sans les dégrader. Les immunoglobulines colostrales échappent aux processus de digestion enzymatique, encore immatures chez le nouveau-né, et sont absorbées intactes au niveau de l’intestin grêle. L’absorption des macromolécules chez le nouveau-né se fait en deux étapes : internalisation des macromolécules dans les cellules épithéliales par pinocytose et transport des macromolécules vers le sang. La pinocytose intestinale est un mécanisme non spécifique qui n’est présent que durant une courte période (Crawford et al., 2003).
Il existe également un transport sélectif qui consiste en l’endocytose des immunoglobulines après fixation à des récepteurs présents sur les entérocytes : les récepteurs FcγRn (Fragment cristallisable gamma Récepteur). Celui-ci transporte de manière sélective le fragment constant de l’IgG de la lumière intestinale à la circulation lymphatique sans dégradation (Buddington, 1996).
Entre J0 et J10, le chaton se nourrit exclusivement de lait. La digestion des protéines contenues dans le lait débute sous l’action de la chymosine. Cette enzyme du suc gastrique coagule le lait et hydrolyse partiellement la caséine. La pepsine continue ensuite la digestion protéique. L’activité de cette enzyme est soumise au pH du suc gastrique. Or, chez le chaton, ce dernier est plus élevé que chez l’adulte en raison d’une faible production d’acide chlorhydrique par l’estomac. La pepsine est donc peu active chez le chaton nouveau-né (Zabielski et al., 1999).
- Digestion des glucides
Les premiers jours de vie, celle-ci est concentrée sur la digestion du lactose, qui fait partie des principales sources d’énergie du lait. Les autres oses de petite taille tels que saccharose, maltose, isomaltose peuvent également être digérés. En revanche, les oses à longue chaine ne sont pas ou presque pas digérés. En effet, l’alpha-amylase est alors peu active (Harper et Turner, 2000).
- Digestion des lipides
La digestion des lipides du lait est possible grâce à la lipase. Cette enzyme est présente dans le suc gastrique et le lait ingéré (Reece, 1997). La lipase pancréatique est peu sécrétée le premier jour mais augmente ensuite en parallèle des lipides dans le lait de la mère les 10 premiers jours de vie (Peterson et Kutzler, 2011).
Les paramètres biochimiques de la fonction hépatique
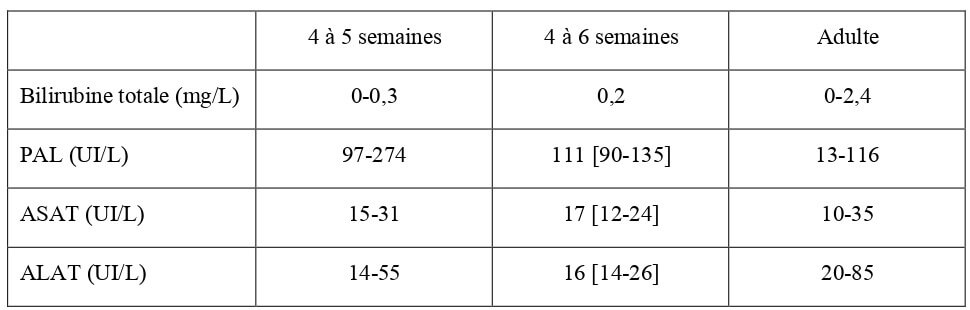
Les concentrations sanguines en alanine-aminotransférase (ALAT), aspartate-aminotransférase (ASAT), phosphatase alcalines et bilirubine totale sont présentées dans le Tableau 19.
Tableau 19 : Moyennes des paramètres biochimiques de la fonction hépatique chez le chaton à la naissance, le premier jour et le septième jour de vie (Von Dehn, 2014), entre 0 et 2 semaines de vie (Bonagura et al., 2014) et chez le chat adulte (Hébert, 2010).
| Naissance | J1 | J7 | 0 à 2 semaines | Adulte | |
| Bilirubine totale (mg/L) | 0,1-1,1 | 0,1-1,6 | 0-0,6 | 3 [1-10] | 0-2,4 |
| PAL (UI/L) | 184-538 | 1348-3715 | 126-363 | 123 [68-269] | 13-116 |
| ASAT (UI/L) | 21-126 | 75-263 | 15-45 | 8-48 | 10-35 |
| ALAT (UI/L) | 7-42 | 29-77 | 11-76 | 21 [10-38] | 20-85 |
Aspect normal des selles
Système urinaire
- Filtration glomérulaire et réabsorption tubulaire
La néphrogenèse se poursuit les 10 premiers jours de vie. La maturation des reins se fait de façon centrifuge, les néphrons de la jonction cortico-médullaire devenant matures avant les néphrons sous-capsulaires.
Le débit de filtration glomérulaire du chaton à J0 équivaut à 20 à 25% celui de l’adulte, et augmente très progressivement au cours des 10 premiers jours de vie. Ceci est dû à une pression artérielle faible et un épithélium glomérulaire peu perméable (Fettman et Allen, 1991).
De même, la réabsorption tubulaire du chaton de 0 à 10 jours est immature. La capacité de concentration des urines est peu développée : ces dernières ne sont qu’1,5 fois plus concentrées que le sang chez le chaton de moins de 10 jours contre 4 à 5 fois chez le chat adulte ; sa densité urinaire est inférieure à 1.020 (Little, 2011). Conséquence d’une moindre réabsorption des molécules organiques par les tubules, les concentrations urinaires en protéines, glucose et acides aminés sont plus élevées chez le nouveau-né que chez l’adulte. Une glycosurie physiologique chez le chaton de 0 à 10 jours est donc fréquente. De même, une protéinurie est observée jusqu’à 15 heures après la naissance. Ceci est la conséquence de l’absorption intestinale des protéines colostrales et de la perméabilité de l’épithélium glomérulaire. Après la fermeture de la barrière intestinale, le ratio protéines sur créatinine urinaire (RPCU) du chaton est semblable à celui de l’adulte. De plus, la clairance rénale de la créatinine du chaton de 0 à 10 jours est d’environ 1,39 à 3,59 mL/min/kg, contre 3,80 à 4,74 mL /min/kg chez le chaton de 9 à 19 semaines (Dial, 1992).
Le nouveau-né est également prédisposé à l’acidose métabolique. D’un côté, le métabolisme du chaton a un rythme deux fois plus élevé que celui de l’adulte, donc produit deux fois plus d’acides. De l’autre, la capacité d’excrétion urinaire des protons est faible (Lage, 1980, cité par Gauclère, 1993)
- Conséquences sur l’utilisation de médicaments en pratique
L’immaturité rénale est à prendre en compte lors de l’administration de médicaments excrétés ou métabolisés par les reins chez le chaton de 0 à 10 jours. En effet, leur clairance rénale est diminuée, ce qui peut induire des effets secondaires indésirables comme une néphrotoxicité ou une augmentation de leur durée d’action. C’est le cas notamment de la kétamine et de certains antibiotiques (céphalosporines, pénicillines, tétracyclines, trimétoprimes-sulfates) (Dial, 1992). L’antibiotique de choix cité par les auteurs est généralement le ceftiofur (2,5mg/kg par voie sous-cutanée toutes les 12 h pendant un maximum de 5 jours). L’utilisation d’anti-inflammatoires non stéroïdiens chez le nouveau-né est déconseillée du fait de leur toxicité rénale accrue chez ce sujet (Grundy, 2006).
- Paramètres biochimiques de la fonction rénale
La créatininémie
La créatininémie est plus faible qu’à l’âge adulte : 0,2 à 0,6 mg/dL de sang chez un chaton de 0 à 2 semaines en bonne santé. Ceci peut en partie être expliqué par une masse musculaire proportionnellement plus faible que chez l’adulte Tableau 20.
Tableau 20 : Créatininémie du chaton entre 0 et 10 jours de vie (Giry, 2002 ; Levy et al., 2006) et du chat adulte (Hébert, 2005).
| A la naissance | J1 | J2 | J4 | J7 | 0 à 2 semaines | Adulte | |
| Créatinine (mg/dL) | 1,2-3,1 | 0,6-1,2 | 0,5-1,1 | 0,5-0,8 | 0,3-0,7 | 0,2-0,6 |
6,8-19 |
L’urémie
L’urémie chez le chaton dépend de la durée du jeûne (temps écoulé entre le dernier repas et le prélèvement sanguin). En moyenne, sa valeur est comprise entre 0,47 et 1,2 mg/dL chez le chaton de 0 à 2 semaines en bonne santé Tableau 21.
Tableau 21 : Urémie du chaton entre 0 et 10 jours de vie (Giry, 2002 ; Levy et al., 2006) et du chat adulte (Hébert, 2005).
| A la naissance | J1 | J2 | J4 | J7 | 0 à 2 semaines | Adulte | |
| Urée (mg/dL) | 2,6-4,5 | 3,4-9,4 | 2,4-7,1 | 1,6-4,1 | 1,6-3,6 | 0,47-1,2 | 8,7-31 |
Les besoins hydriques du chaton de moins de 2 mois sont estimés à 120 à 180 mL par kg de poids corporel, donc plus importants que l’adulte (50 à 100 mL/kg). Ceci est dû à une plus forte teneur en eau dans son organisme (80% contre 60 % pour le chat adulte), un rapport surface sur poids corporel plus important (donc des pertes par déshydratation plus importantes), un métabolisme plus rapide et une masse graisseuse plus faible que l’adulte.
Le chaton de 0 à 10 jours est sensible à toute modification du volume liquidien extracellulaire (suite à une diarrhée, des vomissements ou le jeûne). Il est sujet à une déshydratation rapide (Fettman et Allen, 1991), mais celle-ci est difficile à évaluer. Le test du pli de peau n’est pas significatif avant 6 semaines, puisque la peau du chaton contient moins de graisse et plus d’eau que celle du chat adulte. L’humidité des muqueuses est facilement évaluable et est un reflet de l’état d‘hydratation (Moon et al., 2001).
Si le chaton de moins de 0 à 10 jours tolère mal la déshydratation, il est tout aussi sensible à une fluidothérapie excessive ou mal adaptée d’un point de vue électrolytique. Cette dernière peut être à l’origine d’une surcharge cardiovasculaire, un œdème pulmonaire et des hémorragies intracrâniennes.
Miction
Entre 0 et 10 jours, le chaton n’urine pas seul, une stimulation de la zone périanale par la mère est nécessaire. La première miction a lieu dans les 24h suivant la naissance. Le chaton nouveau-né produit entre 5 et 60 mL d’urines par kg de poids corporel et par jour, contre 10 à 20 mL/kg chez le chat adulte. Elles doivent être claires et incolores. Une urine foncée est un signe de déshydratation (Moon et al., 2001).
Comportement
Comportement alimentaire
Au cours des 2-3 premiers jours post-partum, la chatte peut rester en posture d’allaitement pendant des heures, ne laissant les chatons seuls qu’exceptionnellement pour manger elle-même et faire ses besoins. C’est elle qui déclenche la tétée au retour dans le nid, en léchant les chatons et en se plaçant en posture d’allaitement (Turner et Bateson, 2014).
Aux alentours de 7 jours de vie, date à laquelle les chatons ouvrent les yeux, les chatons trouvent plus facilement des mamelles (Kovach et Kling, 1967).
Le chaton nouveau-né tête toutes les 2 à 4 heures la première semaine, puis toutes les 4 à 6 heures, chaque tétée pouvant durer jusqu’à 45 minutes. Une grande partie de ce temps n’implique pas l’ingestion de lait, ce sont des phases de tétées « non nutritives », qui peuvent représenter 90% d’une séance d’allaitement (Beaver, 1992).
Le jeu a plusieurs intérêts. Il permet un entrainement physique musculaire mais aussi l’amélioration de la coordination et de l’équilibre. De plus, le jeu assure l’exploration de l’environnement et des contacts sociaux entre congénères. On distingue différents types de jeux en fonction de l’objet vers lequel ces derniers sont dirigés : jeux sociaux (impliquant un autre chat), jeux avec des objets, jeux de prédation.
Ils sont tous les trois quasi inexistants (West, 1974 ; Martin et Bateson, 1985).
On distingue différents types de vocalises, émises dans des situations différentes : le ronronnement, le murmure, les miaulements, le hurlement, le grognement, le feulement, le sifflement, le crachement, le cri de douleur et le claquement de dents. Chaque vocalisation est émise dans un contexte particulier.
Le ronronnement est présent dès le 2ème jour. C’est le premier son échangé entre la mère et le chaton au cours de l’allaitement ou de la toilette. Sa fonction n’est pas connue. Il est émis dans des circonstances très contradictoires (d’un moment de plaisir à un moment de douleur intense) (Beaver, 1992).
Le grognement est présent à la naissance mais disparait généralement avec l’âge, sauf très occasionnellement chez les adultes (Beaver, 1992).
Système neurologique
Capacités sensorielles
- Vision
Les yeux du chaton commencent à s’ouvrir entre 2 et 16 jours après sa naissance, avec une moyenne de 8 jours (Villablanca et Olmstead, 1979 ; Beaver, 1980). Plusieurs facteurs rentrent en jeu : la génétique, l’âge de la mère (plus elle est jeune, plus les chatons ouvrent leurs yeux rapidement), le sexe des chatons (les femelles ouvrent leurs yeux plus rapidement que les mâles), l’intensité des manipulations (plus elle est importante, plus le chaton ouvrira ses yeux précocement) (Martin et Bateson, 1985). L’initiation de l’ouverture se fait au bord médial de l’œil, et dans la majorité des cas elle est bilatérale symétrique (Beaver, 1980).
Lorsque les yeux s’ouvrent, la vision est encore immature. Les liquides optiques ne sont pas encore complètement transparents, et le cortex visuel est immature (Bradshaw et al., 2012). Les premières réponses à la lumière se traduisent par une réaction lente de détournement de la tête ou des yeux, 2 jours après l’ouverture (Beaver, 1980).
Les réflexes liés à la vision sont décrits dans la partie « Réflexes liés à la vision ».
- Audition
Les canaux auditifs s’ouvrent progressivement dès la naissance. L’ouverture se fait de manière centripète, en couches, jusqu’atteindre l’extrémité interne du canal. L’ouverture est complète entre J8 et J16 en moyenne (Olmstead et Villablanca, 1980). Le chaton semble répondre aux stimuli auditifs dès 5 jours en moyenne, avec un redressement du corps, des mouvements des pavillons auriculaires et une modification de l’expression faciale (Olmstead et Villablanca, 1980).
- Olfaction
L’olfaction est présente et s’affine progressivement (Beaver, 1980).
- Goût et toucher
Le goût et le toucher sont présents (Bradshaw et al., 2012).
Ce sont des actions volontaires déclenchées qui nécessitent une coordination entre le système sensoriel, la moelle épinière et les motoneurones centraux et périphériques. Leur évaluation permet d’apprécier la symétrie de développement des fonctions neurologiques chez le chaton. Leur présence ou non chez le chaton à la naissance est reportée dans le Tableau 22.
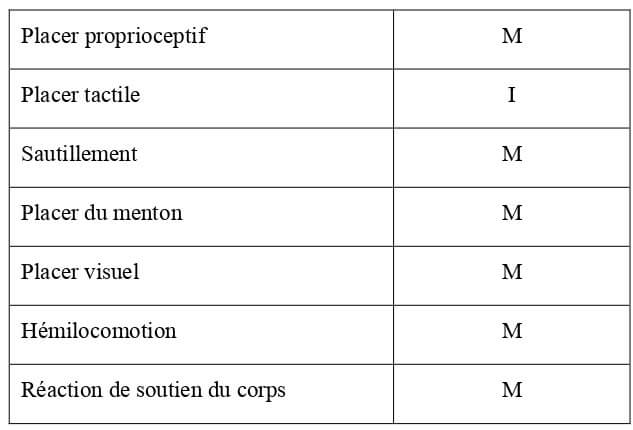
Tableau 22 : Bilan des réactions posturales chez le chaton de 10 jours d’âge (Villablanca et Olmstead, 1979 ; Sechzer et al., 1984 ; Hoskins, 1990). M = réaction mature ; I = réaction immature ou en cours de maturation ; A = réaction absente.
| Placer proprioceptif | M |
| Placer tactile | I |
| Sautillement | I/A |
| Placer du menton | A |
| Placer visuel | A |
| Hémilocomotion | A |
| Réaction de soutien du corps | I |
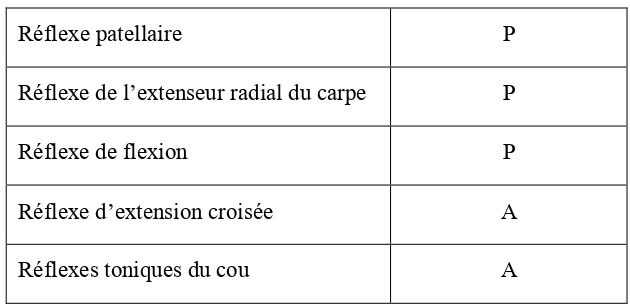
Il s’agit de réactions involontaires déclenchées artificiellement. Un réflexe diminué (hyporéflexie) ou absent (aréflexie) indique une anomalie des fibres sensitives segmentaires et/ou des motoneurones périphériques. Un réflexe augmenté (hyperréflexie) peut montrer une anomalie au niveau des motoneurones centraux. L’évaluation des réflexes sur un chaton est compliquée, de part une hétérogénéité dans leur développement et une difficulté de mise en évidence (Hoskins, 1990). Leur présence ou non chez le chaton de 10 jours est reportée dans le Tableau 23.
Tableau 23 : Bilan des réflexes moteurs chez le chaton de 10 jours d’âge (Hoskins, 1990). P = réflexe présent ; A = réflexe absent.
| Réflexe patellaire | P |
| Réflexe de l’extenseur radial du carpe | P |
| Réflexe de flexion | P |
| Réflexe d’extension croisée | P/A |
| Réflexes toniques du cou | P |
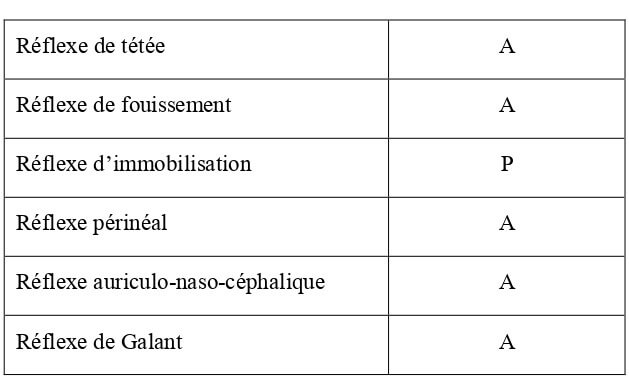
Les réflexes tactiles sont à l’origine des premières interactions du chaton avec sa mère. Leur présence ou non chez le chaton de 10 jours est reportée dans le Tableau 24.
Tableau 24 : Bilan des réflexes liés à une stimulation tactile chez le chaton de 10 jours d’âge (DeGroat et al., 1975 ; Beaver, 1980 ; Gagnon, 2012 ; Bradshaw et al., 2012). P = réflexe présent ; A = réflexe absent.
| Réflexe de tétée | P |
| Réflexe de fouissement | Disparaît entre J8 et J16 |
| Réflexe d’immobilisation | P |
| Réflexe périnéal | P |
| Réflexe auriculo-naso-céphalique | A (disparition à J7) |
| Réflexe de Galant | P/A |
Le réflexe palpébral apparait entre J1 et J3, puis devient mature entre le premier et le neuvième jour en moyenne. Tous les chatons possèdent un réflexe palpébral complet et normal lors de l’ouverture des yeux (Beaver, 1980).
Les études concernant les réflexes de clignement à la lumière et à la menace donnent des résultats différents. Certaines montrent qu’ils apparaissent dans les premiers jours suivant la naissance (entre J1 et J13, avec une moyenne de 6 jours pour le réflexe de clignement à la lumière) (Beaver, 1980), d’autres qu’ils sont présents à la naissance (Villablanca et Olmstead, 1979).
Le réflexe pupillaire apparait souvent au moment de l’ouverture des yeux, plus précisément entre J7 et J18. La réponse est généralement faible au début (Beaver, 1980).
Le réflexe cornéen est présent à l’ouverture des yeux, voire peut-être un peu avant (Villablanca et Olmstead, 1979).
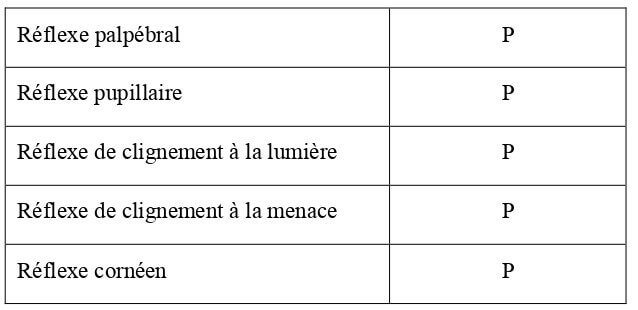
Globalement, les réflexes de protection visuelle (dont le réflexe de clignement à la lumière) apparaissent avant l’ouverture des yeux. Le réflexe pupillaire est très lent les premiers jours (Beaver, 1980). Un bilan des réflexes liés à la vision chez le chaton de 10 jours est présenté dans le Tableau 25.
Tableau 25 : Bilan des réflexes liés à la vision chez le chaton de 10 jours d’âge (Villablanca, Olmstead, 1979 ; Beaver, 1980). P = réflexe présent ; A = réflexe absent.
| Réflexe palpébral | P |
| Réflexe pupillaire | P/A |
| Réflexe de clignement à la lumière | P/A |
| Réflexe de clignement à la menace | P/A |
| Réflexe cornéen | P/A |
Sang
Le volume sanguin total du chaton est de 5 à 10 mL/100g de poids corporel, équivalent à celui du chat adulte (Von Dehn, 2014).
- La lignée rouge
L’hématie du chaton nouveau-né est sensiblement différente de celle du chat adulte. Tout d’abord, elle présente une macrocytose. En effet, son volume globulaire moyen (VGM) est plus élevé que celui de l’adulte (Tableau 26). De plus, elle est produite en plus faible quantité et présente une durée de vie plus courte que celle du chat adulte (66 à 79 jours chez le chaton contre 85 à 90 jours chez le chat adulte (Gauclère, 1993)) . Ceci peut être à l’origine d’un dénombrement important de réticulocytes, de corps d’Howell-Jolly et de corps de Heinz lors de la réalisation d’une cytologie sanguine (Von Dehn, 2014).
L’hématocrite du nouveau-né est élevé à la naissance par rapport aux valeurs usuelles de l’adulte (Tableau 26), d’où le fait qu’il présente physiologiquement une hyperhémie des muqueuses. Il diminue drastiquement les trois premiers jours de vie, puis plus lentement (Von Dehn, 2014).
Les paramètres sanguins relatifs aux hématies chez le chaton à la naissance (hématocrite, hémoglobinémie, VGM, CCMH, TCMH et nombre d’hématies) sont reportés dans le Tableau 26.
L’hémoglobine est de structure identique à celle de l’adulte et possède une affinité semblable au dioxygène (Wellman, 2010).
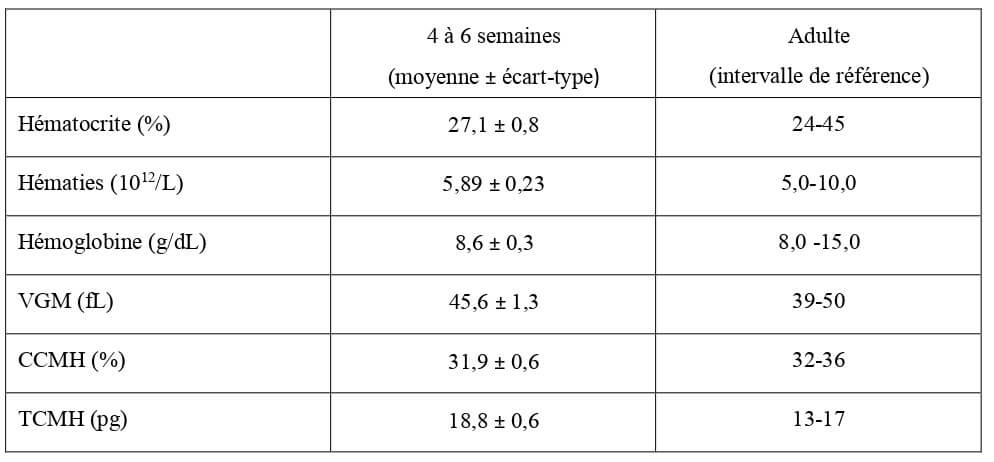
Tableau 26 : Valeurs hématologiques moyennes de la lignée rouge chez le chaton de 0 à 2 semaines en bonne santé (Grundy, 2006) et chez l’adulte (Hébert, 2010). VGM : volume globulaire moyen ; CCMH : concentration corpusculaire moyenne en hémoglobine ; TCMH : teneur corpusculaire moyenne en hémoglobine.
| 0 à 2 semaines (moyenne ± écart-type) |
Adulte (intervalle de référence) |
|
| Hématocrite (%) | 35,3 ± 1,7 | 24-45 |
| Hématies (1012/L) | 5,29 ± 0,24 | 5,0-10,0 |
| Hémoglobine (g/dL) | 12,1 ± 0,6 | 8,0-15,0 |
| VGM (fL) | 67,4 ± 1,9 | 39-50 |
| CCMH (%) | 34,5 ± 0,8 | 32-36 |
| TCMH (pg) | 23,0 ± 0,6 | 13-17 |
- La lignée blanche
Une augmentation significative du nombre de leucocytes est observée entre 0 et 2 semaines, elle peut être attribuée à l’augmentation de la stimulation antigénique à cette période. Cependant, les concentrations sanguines en leucocytes, granulocytes neutrophiles et lymphocytes chez le chaton restent dans les intervalles de référence de l’adulte entre 0 et 10 jours (Tableau 27). Le taux de granulocytes éosinophiles est légèrement supérieur aux normes adultes à cette période.
Tableau 27 : Valeurs hématologiques moyennes de la lignée blanche chez le chaton de 0 à 2 semaines en bonne santé (Grundy, 2006) et chez l’adulte (Hébert, 2010).
| 0 à 2 semaines (moyenne ± écart-type) |
Adulte (intervalle de référence) |
|
| Leucocytes (109/L) | 9,67± 0,57 | 5,5-15,4 |
| Neutrophiles non segmentés (109/L) | 0,06 ± 0,02 | 18,6-40 |
| Neutrophiles segmentés (109/L) | 5,96 ± 0,68 | 2,0-22,3 |
| Lymphocytes (109/L) | 3,73 ± 0,52 | 1,5-7,0 |
| Monocytes (109/L) | 0,01 ± 0,01 | 0,0-0,85 |
| Eosinophiles (109/L) | 0,96 ± 0,43 | 0,0-0,75 |
| Basophiles (109/L) | 0,02 ± 0,01 | 0,0-0,2 |
- Les protéines plasmatiques
Albumine
Entre 0 et 10 jours de vie, la concentration en albumine plasmatique est plus faible qu’à l’âge adulte chez le chat (Tableau 28).
Tableau 28 : Concentration sanguine en albumine du chaton entre 0 et 10 jours de vie (Levy et al., 2006 ; Von Dehn, 2014) et du chat adulte (Hébert, 2010). IR = Intervalle de référence.
| A la naissance (IR) |
J1 (IR) |
J2 (IR) |
J4 (IR) |
J7 (IR) |
Adulte (IR) |
|
| Albumine (g/L) | 25-30 | 19-27 | 16-26 | 18-25 | 20-25 | 24-35 |
Protéines totales
La concentration en protéines totales est plus faible qu’à l’âge adulte à cette période (Tableau 29). Les protéines d’origines colostrales sont dégradées, entraînant une baisse de la concentration sanguine en protéines totales. Le foie, encore immature est incapable de compenser l’expansion rapide du volume plasmatique post-natal en produisant suffisamment de protéines (Hoskins, 1990).
Tableau 29 : Concentration sanguine en protéines totales chez le chaton entre 0 et 10 jours de vie (Levy et al., 2006 ; Von Dehn, 2014) et chez le chat adulte (Hébert, 2010). IR = Intervalle de référence.
| A la naissance (IR) |
J1 (IR) |
J2 (IR) |
J4 (IR) |
J7 (IR) |
Adulte (IR) |
|
| Protéines totales (g/L) | 38-52 | 39-58 | 30-53 | 33-50 | 35-48 | 53-85 |
Ces deux minéraux sont présents en grande quantité dans le sang du chaton au cours de la croissance (Tableau 30).
Tableau 30 : Concentrations sanguines en calcium et phosphore chez le chaton entre 0 et 10 jours de vie (Levy et al., 2006 ; Von Dehn, 2014) et chez le chat à l’âge adulte (Hébert, 2010). IR = Intervalle de référence.
| A la naissance (IR) |
J1 (IR) |
J2 (IR) |
J4 (IR) |
J7 (IR) |
Adulte (IR) |
|
| Calcium (mmol/L) | 2,4-3,5 | 2,4-3,0 | 2,2-3,2 | 2,3-3,6 | 2,5-3,4 | 2,1-2,9 |
| Phosphore (mmol/L) | 1,5-2,8 | 1,2-2,2 | 1,3-3,4 | 1,8-3,5 | 1,7-2,75 | 1,2 -3,0 |
Le glucose sanguin est régulé par trois mécanismes majeurs : l’absorption intestinale, la production hépatique et, à un plus faible degré, la production rénale. Chez le chaton nouveau-né, qui présente notamment une fonction hépatique immature, le potentiel de néoglucogenèse et de glycogénolyse est faible. Par conséquent, la plus grande part de la concentration plasmatique en glucose chez le chaton est d’origine alimentaire. C’est pourquoi le chaton est particulièrement sujet à l’hypoglycémie en cas de stress, maladie, ou toute autre raison entrainant une réduction de l’absorption intestinale de glucose ou un jeûne (Gorman, 2011). La glycémie du chaton entre 0 et 10 jours post-partum est reportée dans le Tableau 31.
Tableau 31 : Concentrations sanguines en glucose chez le chaton entre 0 et 10 jours de vie (Levy et al., 2006 ; Von Dehn, 2014) et chez le chat adulte (Hébert, 2010). IR = Intervalle de référence.
| A la naissance (IR) |
J1 (IR) |
J2 (IR) |
J4 (IR) |
J7 (IR) |
Adulte (IR) |
|
| Glucose (mmol/L) | 3,1-16 | 3,6-8,27 | 4,2-8,5 | 4,6-9,0 | 5,8-8,0 | 2,6-8,4 |
La cholestérolémie et la triglycéridémie sont régies par la production hépatique de cholestérol et par l’absorption intestinale de lipides. Le chaton nouveau-né présente une fonction hépatique immature. Cependant, il se nourrit exclusivement de lait, très riche en lipides (Gorman, 2011). Entre 0 et 10 jours de vie, la cholestérolémie et la triglycéridémie dépassent rapidement les valeurs de l’adulte en même temps que la quantité de lait ingérée augmente (Tableau 32).
Tableau 32 : Concentrations sanguines en cholestérol et en triglycérides chez le chaton entre 0 et 10 jours de vie (Levy et al., 2006 ; Von Dehn, 2014) et chez le chat adulte (Hébert, 2010). IR = Intervalle de référence.
| A la naissance (IR) |
J1 (IR) |
J2 (IR) |
J4 (IR) |
J7 (IR) |
Adulte (IR) |
|
| Cholestérol (mmol/L) | 1,7-3,6 | 1,2-5,4 | 2,1-4,5 | 2,5-2,9 | 3,1-5,5 | 2,0-3,4 |
| Triglycérides (mmol/L) | 0,26-1,5 | 0,34-7,4 | 0,38-10,6 | 1,1-8,7 | 1,5-10,9 | 0,57-1,14 |
La CK (Créatinine Kinase) est une enzyme qui signe une détérioration cellulaire du myocarde ou d’une rhabdomyolyse. Sa valeur à la naissance est très élevée par rapport aux valeurs de l’adulte, du fait du traumatisme subit au moment de la mise-bas par le chaton (Tableau 33).
Tableau 33 : Concentration sanguine en créatinine kinase chez le chaton entre 0 et 10 jours de vie (Levy et al., 2006 ; Von Dehn, 2014) et chez le chat adulte (Hébert, 2010). IR = Intervalle de référence.
| A la naissance (IR) |
J1 (IR) |
J2 (IR) |
J4 (IR) |
J7 (IR) |
Adulte (IR) |
|
| CK (UI/L) | 91-2300 | 519-2564 | 115-974 | 101-616 | 107-445 | 0-820 |
Système immunitaire
Le premier jour de vie, le système immunitaire du chaton est fonctionnel mais totalement naïf, n’ayant été soumis qu’à des sollicitations antigéniques faibles. Dépourvu de cellules mémoires, il élabore une réponse de type primaire, d’intensité plus modérée et plus lente à se mettre en place qu’une réponse secondaire. Il est également déficitaire en éléments de l’immunité spécifique (leucocytes, enzymes, facteurs du complément).
Concernant l’immunité spécifique, les lymphocytes B, assurant l’immunité à médiation humorale, se développent d’abord dans le foie fœtal puis dans la moelle osseuse. Ils sont ensuite distribués dans les tissus lymphoïdes secondaires, et notamment les nœuds lymphatiques et la rate. La prolifération de lymphocytes T, assurant l’immunité à médiation cellulaire, est faible entre J0 et J10. Ceci pourrait expliquer en partie la fragilité des chatons face aux affections bactériennes. L’activité hématopoïétique du thymus croit pendant les premières semaines de vie (Tizard, 2009).
La protection du nouveau-né est assurée par des anticorps d’origine maternelle. Chez le chaton, en raison d’une placentation de type endothélio-chorial, ces anticorps sont transmis juste après la naissance par voie colostrale. Son système digestif permet durant les premières heures de vie le passage sans dégradation des macromolécules de la lumière du tractus vers la circulation sanguine. Par conséquent, les IgG colostrales peuvent ainsi être absorbées par le nouveau-né. Cette absorption est maximale pendant les 6 heures qui suivent la mise bas, pour devenir insuffisante à partir de la 15ème heure (Casal et al., 1996). C’est pour cela qu’il est primordial de s’assurer que tous les chatons ont accès aux mamelles dès leur naissance. Lorsque la prise de colostrum a été correcte, le nouveau-né possède un taux d’IgG sériques protectrices équivalent à celui de sa mère. Celui-ci est de plus dépendant de l’état sanitaire et vaccinal de la femelle. Selon Levy et al., 2001, l’apport par voie sous-cutanée ou per-os à la naissance d’un mélange de sérums de chats adultes sains permet d’obtenir une concentration en IgG comparable à celle des chatons ayant tété le colostrum de leur mère. Cependant, selon une autre étude, l’administration par voie sous-cutanée confère une protection largement supérieure à l’apport par voie orale (Crawford et al., 2003). Cette dernière étude montre également l’intérêt de l’utilisation d’IgG de cheval chez le chaton n’ayant pas reçu de colostrum. Bien que celles-ci, administrées par voie sous-cutanée, permettent d’apporter suffisamment d’IgG en quantité, elles n’entrainent pas la phagocytose par les neutrophiles félins, contrairement aux IgG de chat.
L’immunité passive locale apparaît progressivement au cours du développement du chaton. Elle est constituée par les IgA et les IgG contenues dans le colostrum et le lait. Au cours des 48 premières heures post-partum, les sécrétions mammaires voient leur concentration en IgG et IgA chuter rapidement : on parle alors de lait. La quantité d’IgG dans le colostrum de la chatte est de 62,05 ± 23,85 g/L, celle d’IgA de 1,43 ± 1,16 g/L (Claus et al., 2006). Au bout de 7 jours post-partum, la quantité d’IgG dans le lait chute à 5,33 ± 7,29 g/L, celle d’IgA atteint 0,29 ± 0,23 g/L (Claus et al., 2006). Elles continuent ensuite de chuter au cours des 10 premiers jours de vie.
En conséquence de la maturation du système digestif, les IgG sont de plus en plus dégradées par le suc gastrique et les enzymes intestinales du chaton. D’autre part, les entérocytes n’expriment plus le récepteur FcγRn, capable de transporter de manière sélective la portion Fc de l’IgG de la lumière intestinale à la circulation sans dégradation (Crawford et al., 2003). Les IgA sont quant à elles plus résistantes aux protéases.
Au minimum 97% des immunoglobulines circulantes chez le chaton proviennent du colostrum. Ainsi, grâce à ce dernier, à 48 h de vie, le taux sérique d’immunoglobulines G atteint un pic à 19,15 ± 8,51 g/L. Le taux sérique d’immunoglobulines A atteint lui un sommet à 0,32 ± 0,31 g/L (Claus et al., 2006). L’un comme l’autre chutent ensuite au cours des 10 premiers jours de vie.
La protection humorale transmise par la mère au chaton peut varier considérablement d’un sujet à l’autre, en fonction de la prise colostrale. De plus, le niveau de protection diminue rapidement dans le temps : le taux d’IgG circulant chez le chaton diminue de moitié tous les 8 à 10 jours (Casal et al., 1996). Des demi-vies des immunoglobulines ont été déterminées selon les agents pathogènes (Tableau 34). La durée de protection des chatons par immunité passive dépend également du statut immunitaire de la mère : plus la mère a un titre d’anticorps élevé contre un agent pathogène donné et plus le chaton sera protégé longtemps (Gauclère, 1993).
Tableau 34 : Demi-vie des immunoglobulines G maternelles chez les chatons nouveau-nés et durée de protection moyenne contre les principaux agents pathogènes (Gauclère, 1993). NB : la durée de protection n’est qu’indicative, elle dépend du statut vaccinal de la mère.
| Agent pathogène | Demi-vie des IgG (jours) | Durée de protection (semaines) |
| Feline Parvovirus FPV | 9,5 | 8-14 |
| FeLV | 15 | 6-8 |
| Herpès-virus FHV | 18,5 | 6-8 |
| Calicivirus FCV | 15 | 9-14 |
| Coronavirus FCoV | 7 | 4-6 |
| Lyssavirus de la rage | ? | 13 |
| Chlamydophila felis | ? | 8-12 |
Ainsi, dans l’hypothèse où la prise colostrale a été correcte et où le calendrier vaccinal de la mère a été respecté, le chaton de 0 à 10 jours se trouve protégé contre les principales maladies : panleucopénie, leucose, herpèsvirose, calicivirose, coronavirose, rage et chlamydiose (Gauclère, 1993).
A cet âge-là, les chatons ayant ingéré le colostrum de leur mère vaccinée sont protégés tant que les anticorps maternels persistent. Ces derniers protègent le chaton contre l’agent infectieux mais provoquent également des interférences vaccinales. En effet, ils induisent une neutralisation des antigènes vaccinaux et inhibent donc le développement de la réponse immunitaire. Dans le cas d’un chaton n’ayant pas ingéré de colostrum, une réponse immunitaire à un vaccin peut être observée à partir de 2 jours de vie.
Jour 10 à Jour 20

Croissance
- Calcul du poids idéal grâce au gain moyen quotidien :
La croissance d’un individu est reflétée par son gain moyen quotidien, exprimé en grammes par jour. Il est calculé comme suit :
GMQJa-Jb = (PJb – PJa) / (a–b)
Cet indice peut être exprimé en pourcentage du poids au jour a (Ja). Entre 10 et 20 jours de vie, l’objectif est de croissance est de 5 à 10 % de poids de naissance par jour (Greco et Watters, 1990), ou au moins 7 à 10 grammes par jour (Kirk et al., 2000). Ces deux modes de calcul aboutissent à des valeurs équivalentes.
Ainsi, à l’âge de 20 jours, le chaton dont le poids de naissance varie entre 85 et 120 grammes devrait peser au moins 225 à 320g selon Kirk et al., ou entre 170 et 360g selon Greco et Watters.
- Calcul du poids idéal grâce au gain moyen hebdomadaire :
Il existe également un autre indice reflétant la croissance à plus grande échelle : le gain moyen hebdomadaire (en grammes par semaine). Il est calculé comme suit :
GMH = Pt+1semaine – Pt
La littérature fournit des objectifs sensiblement différents selon les auteurs. Le chaton doit prendre 100g par semaine (Greco et Watters, 1990 ; Kirk et al., 2000), ou entre 50 et 100g par semaine (Peterson, 2011).
Ainsi, le chaton de deux semaines devrait peser entre 285 et 320g (Greco et Watters, 1990 ; Kirk et al., 2000).
- Calcul du poids idéal grâce aux facteurs de multiplication du poids :
Le poids du chaton devrait être multiplié par deux au bout de 2 semaines (Greco et Watters, 1990), ou à l’âge de 10-14 jours (Root Kustritz, 2011).
- Courbe de croissance :
La littérature fournit des objectifs de croissance. Gast a réalisé une courbe de croissance sur 370 chatons en bonne santé (Figure 3), nous permettant de visualiser l’allure de celle-ci entre 10 et 20 jours de vie. Néanmoins, la croissance du chaton entre 10 et 20 jours de vie varie en fonction du sexe, de la taille de la portée, du poids de naissance (Gast, 2011).
Figure 3 : Poids moyen (avec IC 95%) (en grammes) des chatons « en bonne santé » au cours de la croissance et grossissement sur la période entre 10 et 20 jours de vie (Gast, 2011).
Système cardio-vasculaire
Anatomie cardio-vasculaire
Le ratio des masses des ventricules droit et gauche d’un chat adulte est atteint à l’âge de 2 semaines : il est alors de 1/3, le ventricule gauche étant trois fois plus lourd que le droit. La croissance des deux ventricules est ensuite symétrique (McIntosh Bright et Holmberg, 1990).
Le foramen ovale est fermé de façon fonctionnelle, il est susceptible de se rouvrir sous l’effet d’une modification du taux d’oxygène dans le sang ou de l’équilibre acido-basique, lors d’une infection respiratoire par exemple (Voldoire, 2002). La date de sa fermeture définitive n’est pas citée dans la littérature.
Fonction cardiaque
- Auscultation
Fréquence et rythme cardiaques
L’auscultation du cœur est difficile du fait de la taille du thorax et de la fréquence cardiaque élevée. Elle doit se réaliser à gauche, au niveau de l’apex cardiaque, entre le 5ème et le 6ème espace intercostal, dans le tiers ventral du thorax. L’usage d’un stéthoscope pédiatrique est conseillé (Root Kustritz, 2011).
La fréquence cardiaque normale d’un chaton de 10 à 20 jours est d’environ 240 ± 20 battements par minute (bpm) (Lourenço et Ferreira, 2003).
Le rythme cardiaque est un rythme cardiaque sinusal régulier chez le chaton de 10 à 20 jours (McIntosh Bright et Holmberg, 1990).
Souffles physiologiques
Des souffles cardiaques de grades 1/6 à 3/6 entendus chez les chatons nouveau-nés sont le plus souvent causés par le flux sanguin aortique ou pulmonaire rapide ou des délais variables de fermeture des shunts intracardiaques ou entre le cœur et les grands vaisseaux (Root Kustritz, 2011). Les souffles de grades 4/6 à 6/6 sont généralement dus à des malformations cardiaques congénitales. Les plus fréquentes chez le chat sont la dysplasie de la valve tricuspide et l’aplasie du septum ventriculaire (Root Kustritz, 2011).
- Electrocardiogramme
L’électrocardiographie (ECG) est rarement réalisée sur des chatons de 10 à 20 jours mais permettrait de détecter des arythmies ou des défauts de conduction. L’onde P présente une amplitude et durée semblables à celles de l’adulte. La durée et l’amplitude du complexe QRS et des intervalles PR et QT le sont également. On observe durant cette période une augmentation progressive de la durée de l’onde R (Lourenço et Ferreira, 2003).
- Pression artérielle
La pression artérielle du chaton de 10 à 20 jours est comprise entre 40 à 50 mmHg. Ces faibles valeurs sont dues aux parois musculaires artérielles immatures et à une faible résistance artérielle périphérique. Chez le chaton nouveau-né, l’analyse des variations de la pression sanguine ne permet pas de diagnostiquer un choc hypovolémique (Giry, 2002).
- Adaptabilité cardiaque
Le chaton de 10 à 20 jours présente un débit cardiaque, un volume plasmatique, une pression veineuse centrale et une post-charge plus élevés que chez l’adulte. Au contraire, la pression artérielle moyenne, le volume d’éjection systolique, la résistance vasculaire périphérique et la précharge sont plus faibles (McIntosh Bright et Holmberg, 1990). La masse myocardique contractile et la compliance ventriculaire (capacité des ventricules à se dilater) sont également plus faibles. Ainsi, la réserve cardiaque est faible et le volume d’éjection systolique ne varie pas (Giry, 2002). Le débit cardiaque du chaton (DC = VESxFC avec DC : Débit cardiaque (L/min) ; VES : Volume d’éjection systolique (L) ; FC : Fréquence cardiaque (bpm)) ne dépend donc que de la fréquence cardiaque (McIntosh Bright et Holmberg, 1990).
Ainsi, le cœur du chaton a une très faible capacité d’adaptation en fonction des évènements (repos/exercice). De plus, le contrôle nerveux de la fréquence cardiaque est mauvais chez le chaton nouveau-né. Leur myocarde est moins dense en fibres sympathiques. Jusque là, le cœur du chaton est incapable notamment de répondre à une hypovolémie par une tachycardie. Ainsi, le chaton est sensible aux pertes sanguines, même peu importantes (5-10mL/kg). Ceci est à prendre en compte lors de prélèvements sanguins notamment (ils ne doivent pas excéder 0,5mL pour 100g de poids) (McIntosh Bright et Holmberg, 1990).
Système respiratoire
Anatomie et physiologie de l’arbre respiratoire
Entre 10 et 20 jours après la naissance, l’arbre respiratoire achève son expansion et le système respiratoire atteint une efficacité proche de l’adulte (Giry, 2002). Les voies respiratoires, plus souples que chez l’adulte, commencent progressivement à se rigidifier. Bien que la résistance à l’écoulement de l’air et les risques d’obstruction diminuent, l’effort respiratoire reste plus intense qu’à l’âge adulte (Giry, 2002). La cage thoracique du chaton subit le même sort elle s’ossifie peu à peu et le mouvement respiratoire devient plus aisé (Giry, 2002).
Durant la période néonatale, l’appareil respiratoire du chaton est très sensible à la température de l’air, à sa teneur en oxygène, à ses composants toxiques ou irritants ainsi qu’aux agents infectieux qu’il contient (Grundy, 2006).
D’autre part, le chaton de moins de 15 jours a des besoins en oxygène deux à trois fois plus élevés que l’adulte (Voldoire, 2002). C’est pourquoi il a une fréquence respiratoire plus élevée que le chat adulte : entre 18 et 36 mouvements par minutes la deuxième semaine. Ce besoin important en oxygène peut être expliqué par plusieurs particularités : la taille importante de la langue par rapport à la cavité buccale (qui restreint le passage de l’air) (Voldoire, 2002) et le volume courant, inférieur à celui de l’adulte (Moon et al., 2001). Ces besoins diminuent ensuite graduellement. La fréquence respiratoire est de 16 à 36 mpm la troisième semaine (Little, 2011). Le chaton présente une amplitude respiratoire et une réserve pulmonaire plus faible que l’adulte (Root Kustritz, 2011 ; Moon et al., 2001).
Le chaton nouveau-né se voit donc forcé de fournir un effort respiratoire supérieur à celui de l’adulte, alors que sa résistance à la fatigue musculaire est réduite (Moon et al., 2001). Tout ceci doit être pris en compte lors de l’examen clinique de la fonction respiratoire.
Le chaton entre 10 et 20 jours présente une réponse à l’hypoxie semblable à celle de l’adulte (Moon et al., 2001) avec une augmentation des fréquences respiratoire et cardiaque et du volume inspiratoire.
Le signe caractéristique d’affection respiratoire chez le chaton nouveau-né est la dyspnée ou détresse respiratoire (Root Kustritz, 2011). La détresse respiratoire se manifeste par une fréquence, des efforts et/ou des bruits respiratoires augmentés, une intolérance à l’effort ou un collapsus pulmonaire aigu (Root Kustritz, 2011). De plus, l’halètement est un signe de température augmentée normal chez le chien alors que chez le chaton, il est dans la majorité des cas associé à une détresse respiratoire significative. La respiration bouche ouverte est, elle, considérée comme pathologique chez le chiot et le chaton (Root Kustritz, 2011).
Système digestif
Les dents
La cavité buccale du chaton de 10 à 20 jours ne possède encore aucune dent. Les premières dents déciduales qui apparaissent sont les incisives 1 (101/201/301/401), entre 2 et 3 semaines d’âge. Parallèlement arrivent les incisives 2 déciduales (102/202/302/402), entre 2 et 4 semaines d’âge (Hoskins, 1990).
A la fin de la première semaine, la vitesse de développement du tractus ralentit (Zabielski et al., 1999).
L’ingestion de lait augmente parallèlement à la taille de l’estomac : 1.7mL pour 10g de poids corporel par jour. Elle diminue cependant proportionnellement au poids corporel à partir de la deuxième semaine de vie (Peterson et Kutzler, 2011). L’épithélium de l’estomac et de l’intestin grêle se développe grâce à la tétée. La quantité de suc gastrique et d’enzymes digestives sécrétés par l’estomac tend à diminuer avec l’âge (proportionnellement au poids corporel). L’activité de la pepsine est stable durant les 2 ou 3 premières semaines de vie (Zabielski et al., 1999).
Le pancréas
La flore bactérienne
La digestion
- Digestion des protéines
Entre J10 et J20, le chaton se nourrit exclusivement de lait. La digestion des protéines contenues dans le lait débute sous l’action de la chymosine. Cette enzyme du suc gastrique coagule le lait et hydrolyse partiellement la caséine. La pepsine continue ensuite la digestion protéique. L’activité de cette enzyme est soumise au pH du suc gastrique. Or, chez le chaton, ce dernier est plus élevé que chez l’adulte en raison d’une faible production d’acide chlorhydrique par l’estomac. La pepsine est donc encore peu active chez le chaton nouveau-né (Zabielski et al., 1999).
- Digestion des glucides
Tout le long de l’alimentation lactée, celle-ci est concentrée sur la digestion du lactose, qui fait partie des principales sources d’énergie du lait. Les autres oses de petite taille tels que saccharose, maltose, isomaltose peuvent également être digérés. En revanche, les oses à longue chaine ne le sont pas ou presque pas. En effet, l’alpha-amylase est quasiment inactive à ce moment-là. Son activité augmente entre J10 et J20 (Harper, Turner, 2000).
- Digestion des lipides
La digestion des lipides du lait est possible grâce à la lipase. Cette enzyme est présente dans le suc gastrique et le lait ingéré (Reece, 1997). La lipase pancréatique augmente en parallèle des lipides dans le lait de la mère (Peterson, Kutzler, 2011). L’efficacité de la digestion des lipides augmente entre J10 et J20 (Harper, Turner, 2000).
Les paramètres biochimiques de la fonction hépatique
Les concentrations sanguines en alanine-aminotransférase (ALAT), aspartate-aminotransférase (ASAT), phosphatase alcalines et bilirubine totale sont présentées dans le Tableau 35.
Tableau 35 : Moyennes des paramètres biochimiques de la fonction hépatique chez le chaton entre 0 et 2 semaines et entre 2 et 4 semaines de vie (Bonagura et al., 2014) et chez le chat adulte (Hébert, 2010).
| 0 à 2 semaines | 2 à 4 semaines | Adulte | |
| Bilirubine totale (mg/L) | 3 [1-10] | 2 [1-2] | 0-2,4 |
| PAL (UI/L) | 123 [68-269] | 111 [90-135] | 13-116 |
| ASAT (UI/L) | 8-48 | 12-24 | 10-35 |
| ALAT (UI/L) | 21 [10-38] | 14 [10-18] | 20-85 |
Système urinaire
Fonction émonctoire du rein
- Filtration glomérulaire et réabsorption tubulaire
La néphrogenèse se poursuit entre 10 et 20 jours de vie. La maturation des reins se fait de façon centrifuge, les néphrons de la jonction cortico-médullaire devenant matures avant les néphrons sous-capsulaires.
Le débit de filtration glomérulaire du nouveau-né équivaut à 25% celui de l’adulte. Il augmente progressivement entre 10 et 20 jours d’âge. Ceci est dû à une pression artérielle faible et un épithélium glomérulaire peu perméable (Fettman et Allen, 1991).
De même, la réabsorption tubulaire du chaton de 10 à 20 jours est immature. La capacité de concentration des urines est donc peu développée : ces dernières sont 1,5 fois plus concentrées que le sang chez le chaton de moins de 20 jours contre 4 à 5 fois chez le chat adulte ; sa densité urinaire est inférieure à 1.020 (Little, 2011). Conséquence d’une moindre réabsorption des molécules organiques par les tubules, les concentrations urinaires en protéines, glucose et acides aminés dans les urines du nouveau-né sont plus élevées que chez l’adulte. On rencontre ainsi fréquemment une glycosurie physiologique chez le chaton jusqu’à 2 semaines d’âge. Entre 10 et 20 jours, le ratio protéines sur créatinine urinaire (RPCU) du chaton est semblable à celui de l’adulte. De même, la clairance rénale de la créatinine du chaton de 10 à 20 jours est d’environ 1,39 à 3,59 mL/min/kg, contre 3,80 à 4,74 mL /min/kg chez le chaton de 9 à 19 semaines (Dial, 1992).
La concentration urinaire est plus faible que chez l’adulte mais plus élevée qu’à la naissance. En effet, la fonction tubulaire des néphrons est immature (Lage, 1980, cité par Gauclère, 1993).
Le chaton de 10 à 20 jours est prédisposé à l’acidose métabolique. D’un côté, le métabolisme du chaton a un rythme deux fois plus élevé que celui de l’adulte, donc produit deux fois plus d’acides. De l’autre, la capacité d’excrétion urinaire des protons est faible (Lage, 1980, cité par Gauclère, 1993).
- Conséquences sur l’utilisation de médicaments en pratique
L’immaturité rénale est à prendre en compte lors de l’administration de médicaments excrétés ou métabolisés par les reins. En effet, leur clairance rénale est diminuée, ce qui peut induire des effets secondaires indésirables comme une néphrotoxicité ou une augmentation de leur durée d’action. C’est le cas notamment de la kétamine et de certains antibiotiques (céphalosporines, pénicillines, tétracyclines, trimétoprimes-sulfates) (Dial, 1992). L’antibiotique de choix cité par les auteurs est généralement le ceftiofur (2,5mg/kg par voie sous-cutanée toutes les 12 h pendant un maximum de 5 jours). L’utilisation d’anti-inflammatoires non stéroïdiens chez le chaton de 10 à 20 jours est déconseillée du fait de leur toxicité rénale accrue chez ce sujet (Grundy, 2006).
- Paramètres biochimiques de la fonction rénale
La créatininémie
La créatininémie est plus faible qu’à l’âge adulte : 0,4 à 0,6 mg/dL de sang chez un chaton de 2 semaines en bonne santé. Ceci peut en partie être expliqué par une masse musculaire proportionnellement plus faible Tableau 36.
Tableau 36 : Créatininémie du chaton à 14 jours de vie (Giry, 2002 ; Levy et al., 2006) et du chat adulte (Hébert, 2005).
| J14 | Adulte | |
| Créatinine (mg/dL) | 0,4-0,6 | 6,8-19 |
L’urémie
L’urémie chez le chaton dépend de la durée du jeûne (temps écoulé entre le dernier repas et le prélèvement sanguin). En moyenne, sa valeur est comprise entre 1,1 et 3,0 mg/dL chez le chaton de 2 semaines en bonne santé Tableau 37.
Tableau 37 : Urémie du chaton à 14 jours de vie (Giry, 2002 ; Levy et al., 2006) et du chat adulte (Hébert, 2005).
| J14 | Adulte | |
| Urée (mg/dL) | 1,1-3,0 | 8,7-31 |
Régulation hydrique et conséquences en pratique
Les besoins hydriques du chaton de 10 à 20 jours sont estimés à 120 à 180 mL par kg de poids corporel, donc plus importants que l’adulte (50 à 100 mL/kg). Ceci est dû à une plus forte teneur en eau dans son organisme (80% contre 60 % pour le chat adulte), un rapport surface sur poids corporel plus important (donc des pertes par déshydratation supérieures), un métabolisme plus rapide et une masse graisseuse plus faible.
Le chaton de 10 à 20 jours est sensible à toute modification du volume liquidien extracellulaire (suite à une diarrhée, des vomissements ou un jeûne). Il est sujet à une déshydratation rapide (Fettman et Allen, 1991) mais celle-ci est difficile à évaluer. Le test du pli de peau n’est pas significatif entre 10 et 20 jours, puisque sa peau contient moins de graisse et plus d’eau que celle du chat adulte. Cependant, l’humidité des muqueuses est facilement évaluable et est un reflet de l’état d’hydratation (Moon et al., 2001).
Si le chaton de 10 à 20 jours tolère mal la déshydratation, il est tout aussi sensible à une fluidothérapie excessive ou mal adaptée d’un point de vue électrolytique. Cette dernière peut être à l’origine d’une surcharge cardiovasculaire, un œdème pulmonaire et des hémorragies intracrâniennes.
Miction
Comportement
Comportement alimentaire
Entre J10 et J20, le chaton se nourrit du lait maternel. Le chaton s’approche plus rapidement des mamelles grâce à sa vision qui se développe (Kovach et Kling, 1967).
Pendant les 20 premiers jours, c’est encore la chatte qui déclenche la tétée au retour dans le nid, en léchant les chatons et en se plaçant en posture d’allaitement (Turner et Bateson, 2014).
Le chaton à cette période tète toutes les 4 à 6 heures, chaque tétée pouvant durer jusqu’à 45 minutes (Beaver, 1992). Une grande partie de ce temps n’implique pas l’ingestion de lait, ce sont des phases de tétées « non nutritives », qui peuvent représenter 90% d’une séance d’allaitement (Beaver, 1992).
Sommeil
Comportement de jeu et de prédation
Le jeu a plusieurs intérêts. Il permet un entrainement physique musculaire mais aussi l’amélioration de la coordination et de l’équilibre. De plus, le jeu assure l’exploration de l’environnement et des contacts sociaux entre congénères. On distingue différents types de jeux en fonction de l’objet vers lequel ces derniers sont dirigéss : jeux sociaux (impliquant un autre chat), jeux avec des objets, jeux de prédation.
Le comportement de jeu est encore inexistant (Beaver, 1992).
Communication verbale
On distingue différents types de vocalises, émises dans des situations différentes : le ronronnement, le murmure, les miaulements, le hurlement, le grognement, le feulement, le sifflement, le crachement, le cri de douleur et le claquement de dents. Chaque vocalisation est émise dans un contexte particulier.
Le grognement est présent à la naissance mais disparait avec l’âge, sauf très occasionnellement chez les adultes (Beaver, 1992). Le ronronnement, émis à partir de 2 jours après la naissance lors de l’allaitement, est également utilisé comme signe de bienvenue sous forme d’une seule inspiration à partir de 3 semaines d’âge (Beaver, 1992).
Système neurologique
Capacités sensorielles
- Vision
Les yeux du chaton s’ouvrent entre J2 et J16, avec une moyenne de 8 jours (Martin et Bateson, 1985). Lorsque les yeux s’ouvrent, la vision est encore immature. Les liquides optiques ne sont pas encore complètement transparents, et le cortex visuel est immature (Bradshaw et al., 2012). Vers 15 jours, le fond de l’œil commence à être visible. L’éclaircissement débute alors en périphérie (Villablanca et Olmstead, 1979).
Les premières réponses à la lumière se traduisent par une réaction lente de détournement de la tête ou des yeux, 2 jours après l’ouverture (Beaver, 1980). Entre J10 et J19, ou plus précisément entre 1 et 4 jours après l’ouverture, la perception de la profondeur commence à se développer (Beaver, 1980). A partir de J15, les chatons deviennent capables de s’orienter vers un stimulus visuel. La vision et le mouvement se coordonnent (Bradshaw et al., 2012).
Les réflexes liés à la vision sont décrits dans la partie « Réflexes liés à la vision ».
- Audition
Le canal auditif poursuit son ouverture centripète. Celle-ci s’achève entre 8 et 16 jours après la naissance. Les pavillons auditifs se développent également. Leurs mouvements sont considérés identiques à ceux d’un chat adulte entre 15 et 19 jours en moyenne (Olmstead et Villablanca, 1980). Le chaton commence à adapter sa réponse en fonction de la nature du son qu’il entend. Il est par exemple attiré par les miaulements de sa mère et de sa fratrie et repoussé par celui d’un mâle. La discrimination des sons n’est toutefois pas encore tout à fait nette (Olmstead et Villablanca, 1980). Entre J11 et J16, le chaton devient peu à peu capable de localiser la source d’un son (Bradshaw et al., 2012).
- Olfaction
L’olfaction est présente et s’affine progressivement (Beaver, 1980).
- Goût et toucher
Le goût et le toucher sont présents (Bradshaw et al., 2012).
Thermorégulation
Le chaton est encore incapable de réguler sa température corporelle. Il reste encore blotti dans le nid en compagnie de ses frères et sœurs. Jusqu’à J14, s’il est sorti du nid, sa température corporelle diminue de façon linéaire de 0,2 à 0,3°C toutes les 15 minutes, quelle que soit sa température de départ (Olmstead et al., 1979). A partir de J14, il arrive à maintenir sa température lorsqu’il est sorti du nid. Toutefois, la température seuil reste assez basse (entre 37 et 38,2°C) (Olmstead et al., 1979).
A partir de J15, la pilo-érection est observable lorsque le chaton est exposé au froid. Toutefois, le frisson thermique n’est pas encore tout à fait développé, il correspond à de faibles trémulations jusqu’à J10 ou J15 (Olmstead et al., 1979).
Les réactions d’évitement face à une exposition au froid (comme la fuite) commencent à apparaître vraiment à partir de J15. Elles restent encore rares. Les plus fréquentes sont de se blottir en présence de froid, ainsi que de fuir en présence de température trop élevée (Olmstead et al., 1979).
Réactions posturales
Ce sont des actions volontaires déclenchées qui nécessitent une coordination entre le système sensoriel, la moelle épinière et les motoneurones centraux et périphériques. Leur évaluation permet d’apprécier la symétrie de développement des fonctions neurologiques chez le chaton. Leur présence ou non chez le chaton de 20 jours est reportée dans le Tableau 38.
Tableau 38 : Bilan des réactions posturales chez le chaton de 20 jours d’âge (Villablanca et Olmstead, 1979 ; Sechzer et al., 1984 ; Hoskins, 1990). M = réaction mature ; I = réaction immature ou en cours de maturation ; A = réaction absente.
| Placer proprioceptif | M |
| Placer tactile | I |
| Sautillement | I |
| Placer du menton | A |
| Placer visuel | A |
| Hémilocomotion | A |
| Réaction de soutien du corps | M |
Réflexes moteurs
Il s’agit de réactions involontaires déclenchées artificiellement. Un réflexe diminué (hyporéflexie) ou absent (aréflexie) indique une anomalie des fibres sensitives segmentaires et/ou des motoneurones périphériques. Un réflexe augmenté (hyperréflexie) peut montrer une anomalie au niveau des motoneurones centraux. L’évaluation des réflexes sur un chaton est compliquée, de part une hétérogénéité dans leur développement et une difficulté de mise en évidence (Hoskins, 1990). Leur présence ou non chez le chaton de 20 jours est présentée dans le Tableau 39.
Tableau 39 : Bilan des réflexes moteurs chez le chaton de 20 jours d’âge (Hoskins, 1990). P = réflexe présent ; A = réflexe absent.
| Réflexe patellaire | P |
| Réflexe de l’extenseur radial du carpe | P |
| Réflexe de flexion | P |
| Réflexe d’extension croisée | P/A |
| Réflexes toniques du cou | P |
Réflexes liés à une stimulation tactile
Les réflexes tactiles sont à l’origine des premières interactions du chaton avec sa mère. Ils sont en grande partie absents à 20 jours de vie (Tableau 40).
Tableau 40 : Bilan des réflexes liés à une stimulation tactile chez le chaton de 20 jours d’âge (DeGroat et al., 1975 ; Beaver, 1980 ; Gagnon, 2012 ; Bradshaw et al., 2012). P = réflexe présent ; A = réflexe absent.
| Réflexe de tétée | P |
| Réflexe de fouissement | A |
| Réflexe d’immobilisation | A |
| Réflexe périnéal | A |
| Réflexe auriculo-naso-céphalique | A |
| Réflexe de Galant | A |
Réflexes liés à la vision
Le réflexe palpébral, le réflexe de clignement à la menace, le réflexe pupillaire et le réflexe cornéen sont présents et matures (Villablanca et Olmstead, 1979 ; Beaver, 1980).
Globalement, les réflexes de protection visuelle (dont le réflexe de clignement à la lumière) apparaissent avant l’ouverture des yeux. Le réflexe pupillaire est très lent les premiers jours (Beaver, 1980). Un bilan des réflexes liés à la vision est présenté dans le Tableau 41.
Tableau 41 : Bilan des réflexes liés à la vision chez le chaton de 20 jours d’âge (Villablanca et Olmstead, 1979 ; Beaver, 1980). P = réflexe présent ; A = réflexe absent.
| Réflexe palpébral | P |
| Réflexe pupillaire | P |
| Réflexe de clignement à la lumière | P/A |
| Réflexe de clignement à la menace | P |
| Réflexe cornéen | P |
Locomotion
Sang
Volémie
Le volume sanguin total du chaton est de 5 à 10 mL/100g de poids corporel, équivalent à celui du chat adulte (Von Dehn, 2014).
Système hématopoïétique
- La lignée rouge
L’hématie du chaton de 10 à 20 jours d’âge est sensiblement différente de celle du chat adulte. Tout d’abord, elle présente une macrocytose. En effet, son volume globulaire moyen (VGM) est plus élevé que celui de l’adulte (Tableau 42). Il diminue progressivement durant cette période. De plus, elles sont produites en plus faible quantité et présentent une durée de vie plus courte que les hématies du chat adulte (66 à 79 jours chez le chaton contre 85 à 90 jours chez le chat adulte (Gauclère, 1993)). Ceci peut être à l’origine d’un dénombrement important de réticulocytes, de corps d’Howell-Jolly et de corps de Heinz lors de la réalisation d’une cytologie sanguine (Von Dehn, 2014).
L’hématocrite du chaton diminue lentement et atteint les valeurs les plus basses entre 2 et 4 semaines (Tableau 42). Cette anémie physiologique est due à une diminution de la production de globules rouges, une augmentation du volume sanguin (à l’origine d’une hémodilution), la carence physiologique en fer due à la consommation de lait et la destruction des globules rouges fœtaux (Chandler, 2014).
Les paramètres sanguins relatifs aux hématies chez le chaton entre 10 et 20 jours d’âge (hématocrite, hémoglobinémie, VGM, CCMH, TCMH et nombre d’hématies) sont reportés dans le Tableau 42.
L’hémoglobine est de structure identique à celle de l’adulte et possède une affinité semblable au dioxygène (Wellman, 2010).
Tableau42 : Valeurs hématologiques moyennes de la lignée rouge chez le chaton de 0 à 2 semaines et de 2 à 4 semaines en bonne santé (Grundy, 2006) et chez l’adulte (Hébert, 2010).VGM : volume globulaire moyen ; CCMH : concentration corpusculaire moyenne en hémoglobine ; TCMH : teneur corpusculaire moyenne en hémoglobine.
| 0 à 2 semaines (moyenne ± écart-type) |
2 à 4 semaines (moyenne ± écart-type) |
Adulte (intervalle de référence) |
|
| Hématocrite (%) | 35,3 ± 1,7 | 26,5 ± 0,8 | 24-45 |
| Hématies (1012/L) | 5,29 ± 0,24 | 4,67 ± 0,10 | 5,0-10,0 |
| Hémoglobine (g/dL) | 12,1 ± 0,6 | 8,7 ± 0,2 | 8,0-15,0 |
| VGM (fL) | 67,4 ± 1,9 | 53,9 ± 1,2 | 39-50 |
| CCMH (%) | 34,5 ± 0,8 | 33,0 ± 0,5 | 32-36 |
| TCMH (pg) | 23,0 ± 0,6 | 18,8 ± 0,8 | 13-17 |
- La lignée blanche
Les concentrations sanguines en leucocytes, granulocytes neutrophiles et lymphocytes chez le chaton de 10 à 20 jours de vie sont dans les intervalles de référence de l’adulte. L’augmentation significative du nombre de leucocytes observée jusqu’à 2 semaines peut être attribuée à l’augmentation de la stimulation antigénique à cette période. Le taux de granulocytes éosinophiles est légèrement supérieur aux normes adultes (Tableau 43).
Tableau43 :Valeurs hématologiques moyennes de la lignée blanche chez le chaton de 0 à 2 semaines en bonne santé (Grundy, 2006) et chez l’adulte (Hébert, 2010).
| 0 à 2 semaines (moyenne ± écart-type) |
2 à 4 semaines (moyenne ± écart-type) |
Adulte (intervalle de référence) |
|
| Leucocytes (109/L) | 9,67± 0,57 | 15,31 ± 1,21 | 5,5-15,4 |
| Neutrophiles non segmentés (109/L) | 0,06 ± 0,02 | 0,11 ± 0,04 | 18,6-40 |
| Neutrophiles segmentés (109/L) | 5,96 ± 0,68 | 6,92 ± 0,77 | 2,0-22,3 |
| Lymphocytes (109/L) | 3,73 ± 0,52 | 6,56 ± 0,59 | 1,5-7,0 |
| Monocytes (109/L) | 0,01 ± 0,01 | 0,02 ± 0,02 | 0,0-0,85 |
| Eosinophiles (109/L) | 0,96 ± 0,43 | 1,41 ± 0,16 | 0,0 -0,75 |
| Basophiles (109/L) | 0,02 ± 0,01 | 0 | 0,0-0,2 |
- Les protéines plasmatiques
Albumine
Chez le chaton de 10 à 20 jours d’âge, la concentration en albumine plasmatique est en moyenne plus faible qu’à l’âge adulte (Tableau 44).
Tableau44 :Concentration sanguine en albumine chez le chaton de 0 à 2 semaines et de 2 à 4 semaines (Hoskins, 1990), à 14 jours de vie (Levy et al., 2006) et chez le chat adulte (Hébert, 2010).
| 0 à 2 semaines (intervalle de référence) |
J14 (intervalle de référence) |
2 à 4 semaines (intervalle de référence) |
Adulte (intervalle de référence) |
|
| Albumine (g/L) | 20-24 | 21-26 | 22-24 | 24-35 |
Protéines totales
La concentration en protéines totales est plus faible qu’à l’âge adulte (Tableau 45). Le foie, encore immature, est incapable de compenser l’expansion rapide du volume plasmatique post-natale en produisant suffisamment de protéines. C’est la fin de la dégradation des protéines d’origine colostrale (Hoskins, 1990).
Tableau45 : Concentration sanguine en protéines totales chez le chaton à 14 jours de vie (Levy et al., 2006) et chez le chat adulte (Hébert, 2010).
| J14 (intervalle de référence) |
Adulte (intervalle de référence) |
|
| Protéines totales (g/L) | 37-52 | 53-85 |
Minéraux : calcium et phosphore
Ces deux minéraux sont présents en grande quantité dans le sang du chaton de 10 à 20 jours (Tableau 46).
Tableau 46 : Concentrations sanguines en calcium et phosphore chez le chaton à 14 jours de vie (Levy et al., 2006) et chez le chat à l’âge adulte (Hébert, 2010).
| J14 (intervalle de référence) |
Adulte (intervalle de référence) |
|
| Calcium (mmol/L) | 2,5-3,3 | 2,1-2,9 |
| Phosphore (mmol/L) | 2,3-3,6 | 1,2 -3,0 |
Glucose
Le glucose sanguin est régulé par trois mécanismes majeurs : l’absorption intestinale, la production hépatique et, à un plus faible degré, la production rénale. Chez le chaton de 10 à 20 jours, la glycémie est semblable à celle de l’adulte (Tableau 47).
Tableau 47 : Concentration sanguine en glucose chez le chaton à 14 jours de vie (Levy et al., 2006) et chez le chat adulte (Hébert, 2010).
| J14 (intervalle de référence) |
Adulte (intervalle de référence) |
|
| Glucose (mmol/L) | 5,9-8,8 | 2,6-8,4 |
Cholestérol et triglycérides
La cholestérolémie et la triglycéridémie sont régies par la production hépatique de cholestérol et par l’absorption intestinale de lipides. Le chaton de 10 à 20 jours d’âge présente une fonction hépatique immature. Cependant, il se nourrit exclusivement de lait, substance très riche en lipides (Gorman, 2011). A cette période, la cholestérolémie est supérieure aux normes de l’adulte chez le chat (Tableau 48).
Tableau 48 : Concentrations sanguines en cholestérol et en triglycérides chez le chaton à 14 jours de vie (Levy et al., 2006) et chez le chat adulte (Hébert, 2010).
| J14 (intervalle de référence) |
Adulte (intervalle de référence) |
|
| Cholestérol (mmol/L) | 3,5-5,7 | 2,0-3,4 |
| Triglycérides (mmol/L) | 0.43-5,4 | 0,57-1,14 |
Créatine kinase
La CK (Créatinine Kinase) est une enzyme qui signe une détérioration cellulaire du myocarde ou d’une rhabdomyolyse. Sa valeur à la naissance est très élevée par rapport aux valeurs de l’adulte, du fait du traumatisme subit au moment de la mise-bas par le chaton (Tableau 49).
Tableau 49 : Concentration sanguine en créatinine kinase chez le chaton à 14 jours de vie (Levy et al., 2006) et chez le chat adulte (Hébert, 2010).
| J14 (intervalle de référence) |
Adulte (intervalle de référence) |
|
| CK (UI/L) | 99-394 | 0-820 |
Paramètres hépatiques
Paramètres rénaux
Système immunitaire
Organes hématopoïétiques
La plupart des cellules du système immunitaire sont d’origine hématopoïétique. Entre 10 et 20 jours de vie, l’hématopoïèse régresse progressivement dans la rate et le foie. Elle est remplacée dans la rate par la fonction érythroclastique de destruction des hématies vieillissantes. Toutefois, le potentiel hématopoïétique de ces organes pourra se réactiver en cas de besoin. L’hématopoïèse se poursuit tout au long de la vie dans la moelle osseuse après la naissance. Le thymus est le siège de la différenciation et maturation des lymphocytes T. Il est en phase de croissance entre 10 et 20 jours de vie (Chabanne, 2006).
Réponse immunitaire
Entre 10 et 20 jours de vie, le système immunitaire du chaton est encore immature. Il construit progressivement son répertoire de cellules mémoires, en fonction des contacts avec son environnement et ses congénères.
Sa réponse immunitaire est majoritairement de type primaire, d’intensité plus modérée et plus lente à se mettre en place qu’une réponse secondaire. Il est également déficitaire en éléments de l’immunité spécifique (leucocytes, enzymes, facteurs du complément). Concernant cette dernière, les lymphocytes B, assurant l’immunité à médiation humorale, se développent dans la moelle osseuse. Ils sont ensuite distribués dans les tissus lymphoïdes secondaires, et notamment les nœuds lymphatiques et la rate. La prolifération de lymphocytes T, assurant l’immunité à médiation cellulaire, augmente entre J10 et J20 (Person, 2003).
Anticorps d’origine maternelle
La protection du chaton de J10 à J20 est assurée par des anticorps d’origine maternelle. Lorsque la prise de colostrum a été correcte, le nouveau-né possède un taux d’IgG sérique équivalent à celui de sa mère.
L’immunité passive locale apparaît progressivement au cours du développement du chaton. Elle est constituée par les IgA et les IgG contenues dans le lait, dont les concentrations diminuent de façon exponentielle à cet-âge là. A ce stade, les IgG ingérées sont dégradées par le suc gastrique et les enzymes intestinales. D’autre part, les entérocytes n’expriment plus le récepteur FcγRn, capable de transporter de manière sélective la portion Fc de l’IgG de la lumière intestinale à la circulation sans dégradation. Les IgA sont quant à elles plus résistantes aux protéases.
Le taux d’IgG maternelles diminue de moitié tous les 8 à 10 jours (Chabanne, 2006). D’après le calcul de demi-vies, le chaton est encore protégé contre les principales maladies infectieuses, sous réserve de la qualité du transfert et du niveau de protection (Tableau 50).
Tableau 50 : Demi-vie des immunoglobulines G maternelles chez les chatons nouveau-nés et durée de protection moyenne contre les principales maladies (Gauclère, 1993). NB : la durée de protection n’est qu’indicative, elle dépend du statut vaccinal de la mère.
| Agent pathogène | Demi-vie des IgG (jours) | Durée de protection (semaines) |
| Feline Parvovirus FPV | 9,5 | 8-14 |
| FeLV | 15 | 6-8 |
| Herpès-virus FHV | 18,5 | 6-8 |
| Calicivirus FCV | 15 | 9-14 |
| Coronavirus FCoV | 7 | 4-6 |
| Lyssavirus de la rage | ? | 13 |
| Chlamydophila felis | ? | 8-12 |
Ainsi, dans l’hypothèse où la prise colostrale a été correcte et où le calendrier vaccinal de la mère a été respecté, le chaton de 10 à 20 jours se trouve encore protégé contre les principales maladies : panleucopénie, leucose, herpèsvirose, calicivirose, coronavirose, rage et chlamydiose (Gauclère, 1993).
Conséquences sur la vaccination et calendrier vaccinal
A cet âge-là, les anticorps d’origine maternelle exercent une interférence vaccinale. Ainsi, la vaccination du chaton de 10 à 20 jours n’entrainera qu’une réponse vaccinale minime (Bergues et Bertagnoli, 2003). Par ailleurs, les animaux n’ayant pas reçu de colostrum peuvent être vaccinés à partir de la deuxième semaine d’âge avec des vaccins à agents inactivés (période à partir de laquelle la capacité de répondre correctement à une stimulation antigénique est acquise), puis toutes les deux à trois semaines jusqu’à l’âge de trois mois.
Jour 20 à Jour 30

Croissance
- Calcul du poids idéal grâce au gain moyen quotidien :
La croissance d’un individu est reflétée par son gain moyen quotidien, exprimé en grammes par jour. Il est calculé comme suit :
GMQJa-Jb = (PJb – PJa) / (a–b)
Cet indice peut être exprimé en pourcentage du poids au jour a (Ja). Entre 10 et 20 jours de vie, l’objectif est de croissance est de 5 à 10 % de poids de naissance par jour (Greco et Watters, 1990), ou au moins 7 à 10 grammes par jour (Kirk et al., 2000). Ces deux modes de calcul aboutissent à des valeurs équivalentes.
Ainsi, à l’âge de 30 jours, le chaton dont le poids de naissance varie entre 85 et 120 grammes devrait peser au moins 295 à 420g selon Kirk et al., ou entre 213 et 480g selon Greco et Watters.
- Calcul du poids idéal grâce au gain moyen hebdomadaire :
Il existe également un autre indice reflétant la croissance à plus grande échelle : le gain moyen hebdomadaire (en grammes par semaine). Il est calculé comme suit :
GMH = Pt+1semaine – Pt
La littérature fournit des objectifs sensiblement différents selon les auteurs. Le chaton doit prendre 100g par semaine (Greco et Watters, 1990 ; Kirk et al., 2000), ou entre 50 et 100g par semaine (Peterson, 2011).
Ainsi, le chaton de trois semaines devrait peser entre 385 et 420g , celui de quatre semaines entre 485 et 520g (Greco et Watters, 1990 ; Kirk et al., 2000).
- Courbe de croissance :
La littérature fournit des objectifs de croissance. Gast a réalisé une courbe de croissance sur 370 chatons en bonne santé (Figure 4), nous permettant de visualiser l’allure de celle-ci entre 20 et 30 jours de vie. Néanmoins, la croissance du chaton entre 20 et 30 jours de vie varie en fonction du sexe, de la taille de la portée, du poids de naissance (Gast, 2011). Selon Dubos, le chaton mâle de 4 semaines pèse en moyenne 500g, tandis que le chaton femelle pèse en moyenne 450g.
Figure 4 : Poids moyen (avec IC 95%) (en grammes) des chatons « en bonne santé » au cours de la croissance et grossissement sur la période entre 20 et 30 jours de vie (Gast, 2011).
Système cardio-vasculaire
Anatomie cardio-vasculaire
Chez le chaton de 20 jours à 1 mois, le ratio des masses des ventricules droit et gauche d’un chat adulte est atteint : il est de 1/3, le ventricule gauche étant trois fois plus lourd que le droit. La croissance des deux ventricules est ensuite symétrique (McIntosh Bright et Holmberg, 1990).
Le foramen ovale est fermé de façon fonctionnelle, il est susceptible de se rouvrir sous l’effet d’une modification du taux d’oxygène dans le sang ou de l’équilibre acido-basique, lors d’une infection respiratoire par exemple (Voldoire, 2002). La date de sa fermeture définitive n’est pas citée dans la littérature.
Fonction cardiaque
- Auscultation
Fréquence et rythme cardiaques
L’auscultation du cœur est difficile du fait de la taille du thorax et de la fréquence de battements élevée. Elle doit se réaliser à gauche, au niveau de l’apex cardiaque, entre le 5ème et le 6ème espace intercostal, dans le tiers ventral du thorax. L’usage d’un stéthoscope pédiatrique est conseillé (Root Kustritz, 2011).
La fréquence cardiaque normale d’un chaton de 20 jours à 1 mois est d’environ 240 ± 20 battements par minute (bpm) (Lourenço et Ferreira, 2003).
Le rythme cardiaque est un rythme cardiaque sinusal régulier chez le chaton de moins de 6 semaines (McIntosh Bright et Holmberg, 1990).
Souffles physiologiques
Des souffles cardiaques de grades 1/6 à 3/6 entendus chez les chatons de 20 jours à 1 mois sont le plus souvent causés par le flux sanguin aortique ou pulmonaire rapide ou des délais variables de fermeture des shunts intracardiaques ou entre le cœur et les grands vaisseaux (Root Kustritz, 2011). Les souffles de grades 4/6 à 6/6 sont généralement dus à des malformations cardiaques congénitales. Les plus fréquentes chez le chat sont la dysplasie de la valve tricuspide et l’aplasie du septum ventriculaire (Root Kustritz, 2011).
- Electrocardiogramme
L’électrocardiographie (ECG) est rarement réalisée sur des chatons de 20 jours à un mois mais permettrait de détecter des arythmies ou des défauts de conduction. L’onde P présente une amplitude et durée semblables à celles de l’adulte. La durée et l’amplitude du complexe QRS et des intervalles PR et QT le sont également. On observe à l’âge d’un mois une augmentation progressive de la durée de l’onde R, jusqu’à atteindre les valeurs du chat adulte (Lourenço et Ferreira, 2003).
- Pression artérielle
La pression artérielle du chaton de 20 à 30 jours est comprise entre 40 à 50 mmHg. Ces faibles valeurs sont dues aux parois musculaires artérielles immatures et à une faible résistance artérielle périphérique. A cet âge-là, l’analyse des variations de la pression sanguine ne permet pas de diagnostiquer un choc hypovolémique (Giry, 2002).
- Adaptabilité cardiaque
Le chaton de 20 jours à 1 mois présente un débit cardiaque, un volume plasmatique, une pression veineuse centrale et une post-charge plus élevés que chez l’adulte. Au contraire, la pression artérielle moyenne, le volume d’éjection systolique, la résistance vasculaire périphérique et la précharge sont plus faibles (McIntosh Bright et Holmberg, 1990). La masse myocardique contractile et la compliance ventriculaire (capacité des ventricules à se dilater) sont également plus faibles. Ainsi, la réserve cardiaque est faible et le volume d’éjection systolique ne varie pas (Giry, 2002). Le débit cardiaque du chaton (DC = VESxFC avec DC : Débit cardiaque (L/min ; VES : Volume d’éjection systolique (L) ; FC : Fréquence cardiaque (bpm)) ne dépend donc que de la fréquence cardiaque (McIntosh Bright et Holmberg, 1990).
De ce fait, le cœur du chaton a une très faible capacité d’adaptation en fonction des évènements (repos/exercice). De plus, le contrôle nerveux de la fréquence cardiaque est mauvais chez le chaton nouveau-né. Leur myocarde est moins dense en fibres sympathiques. Jusque là, le cœur du chaton est incapable notamment de répondre à une hypovolémie par une tachycardie. Ainsi, le chaton est sensible aux pertes sanguines, même peu importantes (5-10mL/kg). Ceci est à prendre en compte lors de prélèvements sanguins notamment (ils ne doivent pas excéder 0.5mL maximum pour 100g de poids) (McIntosh Bright et Holmberg, 1990).
Système respiratoire
Anatomie et physiologie de l’arbre respiratoire
Les poumons poursuivent leur développement entre 20 jours et 1 mois (Root Kustritz, 2011) : les ramifications de l’arbre respiratoire sont formées mais leur morphologie évolue pur atteindre une efficacité proche de l’adulte (Giry, 2002). Dans un premier temps, les voies respiratoires, plus souples que chez l’adulte, continuent de se rigidifier. Bien que la résistance à l’écoulement de l’air et les risques d’obstruction diminuent, l’effort respiratoire reste plus intense qu’à l’âge adulte (Giry, 2002). La cage thoracique du chaton subit le même sort : elle s’ossifie peu à peu et le mouvement respiratoire devient plus aisé (Giry, 2002).
L’appareil respiratoire du chaton est sensible à la température de l’air, à sa teneur en oxygène, à ses composants toxiques ou irritants ainsi qu’aux agents infectieux qu’il contient (Grundy, 2006).
Les besoins en oxygène du chaton de 20 jours à 1 mois diminuent pour se rapprocher de ceux de l’adulte (Voldoire, 2002). Quant à la fréquence respiratoire, elle ne subit pas de modification importante pendant cette période : entre 16 et 36 mpm la troisième semaine (Little, 2011), entre 20 et 36 mpm la quatrième semaine (Grellet, 2010). Le chaton présente une amplitude respiratoire et une réserve pulmonaire plus faible que l’adulte (Root Kustritz, 2011 ; Moon et al., 2001).
Le chaton nouveau-né se voit donc forcé de fournir un effort respiratoire supérieur à celui de l’adulte, alors que sa résistance à la fatigue musculaire est réduite (Moon et al., 2001). Tout ceci doit être pris en compte lors de l’examen clinique de la fonction respiratoire.
Réponse physiologique face à l’hypoxie
Le chaton entre 20 jours et un mois présente une réponse à l’hypoxie semblable à celle de l’adulte (Moon et al., 2001) avec une augmentation des fréquences respiratoire et cardiaque et du volume inspiratoire.
Le signe caractéristique d’affection respiratoire chez le chaton nouveau-né est la dyspnée ou détresse respiratoire. La détresse respiratoire se manifeste par une fréquence, des efforts et/ou des bruits respiratoires augmentés, une intolérance à l’effort ou un collapsus pulmonaire aigu (Root Kustritz, 2011). De plus, l’halètement est un signe de température augmentée normal chez le chien. Chez le chaton, l’halètement est dans la majorité des cas associé à une détresse respiratoire significative. La respiration bouche ouverte est, elle, considérée comme pathologique chez le chiot et le chaton (Root Kustritz, 2011).
Système digestif
Les dents
Le chaton possède normalement déjà ses incisives 1 déciduales (101, 201, 301 et 401). Les incisives 2 déciduales (102, 202, 302 et 402) font éruption entre 2 et 4 semaines en moyenne. Viennent ensuite les incisives 3 (103, 203, 303 et 403) ainsi que les canines (104, 204, 304 et 404), entre 3 et 4 semaines d’âge. Les dents déciduales sont semblables aux dents permanentes mais de plus petite taille et plus pointues (Hoskins, 1990).
Le tube digestif
L’ingestion de lait augmente : 2mL pour 10g de poids corporel par jour. Elle diminue cependant proportionnellement au poids corporel entre la deuxième et la septième semaine de vie. Parallèlement, l’ingestion d’aliment solide augmente entre la troisième et la septième semaine de vie (Peterson et Kutzler, 2011).
La taille de l’estomac, et par conséquent la capacité d’ingestion, subissent un bond considérable avec l’introduction d’aliments solides (Zabielski et al., 1999). L’épaisseur de la paroi intestinale a presque doublé de part l’hypertrophie de la tunique musculeuse (Peterson et Kutzler, 2011). L’épithélium de l’estomac et de l’intestin grêle poursuit son développement avec les changements alimentaires. La quantité de suc gastrique et d’enzymes digestives sécrétés par l’estomac tend à diminuer avec l’âge (proportionnellement au poids corporel). L’activité de la pepsine augmente (Zabielski et al., 1999).
Le pancréas
La flore bactérienne
La digestion
- Digestion des protéines
Entre J20 et J30, le chaton se nourrit principalement de lait, mais entre cependant pour la première fois en contact avec l’alimentation solide. Encore basse à 20 jours, l’activité de la pepsine augmente parallèlement à la diminution progressive du pH stomacal entre 20 et 30 jours de vie (Reece, 1997).
- Digestion des glucides
Les oses de petite taille tels que lactose, saccharose, maltose, isomaltose peuvent être digérés (Harper et Turner, 2000). En outre, le chaton va, pendant cette période, entrer pour la première fois en contact avec la nourriture solide. Les nouveaux glucides apportés par cette alimentation vont commencer à être pris en charge, notamment les glucides de plus grande taille.
- Digestion des matières lipidiques
L’activité de la lipase pancréatique augmente en parallèle des lipides dans le lait de la mère (Peterson et Kutzler, 2011). En outre, le chaton va, pendant cette période, entrer pour la première fois en contact avec la nourriture solide. Les nouveaux lipides apportés par cette alimentation vont commencer à être pris en charge. L’efficacité de la digestion des lipides augmente entre 20 et 30 jours (Harper et Turner, 2000).
Les paramètres biochimiques de la fonction hépatique
Les concentrations sanguines en alanine-aminotransférase (ALAT), aspartate-aminotransférase (ASAT), phosphatase alcalines et bilirubine totale sont présentées dans le Tableau 51.
Tableau 51 : Moyennes des paramètres biochimiques de la fonction hépatique chez le chaton entre 2 et 4 semaines de vie (Bonagura et al., 2014) et chez le chat adulte (Hébert, 2010).
| 2 à 4 semaines | Adulte | |
| Bilirubine totale (mg/L) | 2 [1-2] | 0-2,4 |
| PAL (UI/L) | 111 [90-135] | 13-116 |
| ASAT (UI/L) | 12-24 | 10-35 |
| ALAT (UI/L) | 14 [10-18] | 20-85 |
Système urinaire
Fonction émonctoire du rein
- Filtration glomérulaire et réabsorption tubulaire
La néphrogenèse s’achève à environ 3 semaines d’âge. Le débit de filtration glomérulaire à cette période continue d’augmenter mais ne correspond encore qu’à environ 40% de celui de l’adulte, en raison d’une pression artérielle faible et d’un épithélium glomérulaire peu perméable (Fettman et Allen, 1991).
De même, la réabsorption tubulaire du chaton de moins d’un mois est encore partiellement immature. La capacité de concentration des urines est donc peu développée : celles-ci sont 1,5 fois plus concentrées que le sang chez le chaton de 20 jours à 1 mois contre 4 à 5 fois chez le chat adulte ; la densité urinaire est inférieure à 1.020 (Little, 2011). Conséquence d’une moindre réabsorption des molécules organiques par les tubules, les concentrations urinaires en protéines, glucose et acides aminés sont plus élevées chez le chaton de 20 jours à 1 mois que chez l’adulte (Fettman et Allen, 1991). Le ratio protéines sur créatinine urinaire (RPCU) du chaton de 20 jours à 1 mois est semblable à celui de l’adulte. De même, la clairance rénale de la créatinine du chaton de moins d’un mois est d’environ 1,39 à 3,59 mL/min/kg, contre 3,80 à 4,74 mL /min/kg chez le chaton de 9 à 19 semaines (Dial, 1992).
- Conséquences sur l’utilisation de médicaments en pratique
L’immaturité rénale est à prendre en compte lors de l’administration de médicaments excrétés ou métabolisés par les reins. En effet, leur clairance rénale est diminuée, ce qui peut induire des effets secondaires indésirables comme une néphrotoxicité ou une augmentation de leur durée d’action. C’est le cas notamment de la kétamine et de certains antibiotiques (céphalosporines, pénicillines, tétracyclines, trimétoprimes-sulfates) (Dial, 1992). L’antibiotique de choix cité par les auteurs est généralement le ceftiofur (2,5mg/kg par voie sous-cutanée toutes les 12 h pendant un maximum de 5 jours). L’utilisation d’anti-inflammatoires non stéroïdiens chez le chaton de 20 jours à 1 mois est déconseillée du fait de leur toxicité rénale accrue chez ce sujet (Grundy, 2006).
- Paramètres biochimiques de la fonction rénale
La créatininémie
La créatininémie est plus faible qu’à l’âge adulte : 0,4 à 0,7 mg/dL de sang chez un chaton de 1 mois en bonne santé. Ceci peut en partie être expliqué par une masse musculaire proportionnellement plus faible Tableau 52.
Tableau 52 : Créatininémie du chaton à 1 mois d’âge (Levy et al., 2006) et du chat adulte (Hébert, 2005).
| 1 mois | Adulte | |
| Créatinine (mg/dL) | 0,4-0,7 | 6,8-19 |
L’urémie
L’urémie chez le chaton dépend de l’alimentation et de la durée du jeûne (temps écoulé entre le dernier repas et le prélèvement sanguin). En moyenne, sa valeur est comprise entre 1,0 et 2,2 mg/dL de sang chez le chaton de 1 mois en bonne santé Tableau 53.
Tableau 53 : Urémie du chaton à 1 mois d’âge (Levy et al., 2006) et du chat adulte (Hébert, 2005).
| 1 mois | Adulte | |
| Urée (mg/dL) | 1,0-2,2 | 8,7-31 |
Régulation hydrique et conséquences en pratique
Les besoins hydriques du chaton de moins de 2 mois sont estimés à 120 à 180 mL par kg de poids corporel, donc plus importants que l’adulte (50 à 100 mL/kg). Ceci est dû à une plus forte teneur en eau dans son organisme (80% contre 60 % pour le chat adulte), un rapport surface sur poids corporel plus important (donc des pertes par déshydratation plus importantes), un métabolisme plus rapide et une masse graisseuse plus faible que l’adulte.
Le chaton de 20 jours à 1 mois est sensible à toute modification du volume liquidien extracellulaire (ex : diarrhée, vomissement, jeûne). Il est sujet à une déshydratation rapide (Fettman et Allen, 1991), mais celle-ci est difficile à évaluer. Le test du pli de peau n’est pas significatif avant 6 semaines, puisque la peau du chaton contient moins de graisse et plus d’eau que celle du chat adulte. L’humidité des muqueuses est facilement évaluable et est un reflet de l’état d‘hydratation (Moon et al., 2001).
Le chaton est tout aussi sensible à une fluidothérapie excessive ou mal adaptée d’un point de vue électrolytique. Cette dernière peut être à l’origine d’une surcharge cardiovasculaire, un œdème pulmonaire et des hémorragies intracrâniennes.
Miction
Comportement
Comportement alimentaire
Pendant cette période, le chaton se nourrit encore du lait maternel. Contrairement aux 3 premières semaines de vie, où la mère provoque la tétée, après 3 semaines, c’est plutôt le chaton qui l’initie (Case, 2011). La chatte la tolère de moins en moins au cours de la 4ème semaine, elle peut parfois refuser que les chatons ne tètent (Martin et Bateson, 1985).
Au cours de la 3ème semaine de vie, dans la nature, la mère commence à rapporter des proies mortes ou blessées au nid pour nourrir ses chatons. Cela représente la première introduction à l’aliment solide pour le chaton. Dans le cadre d’un foyer où les chatons sont soignés par l’homme, c’est également le moment où l’on devrait introduire l’aliment solide (Case, 2011). La première ingestion d’aliment solide a lieu entre J20 et J30 mais peut considérablement changer d’une portée à l’autre. Elle est concomitante d’une forte poussée de croissance et à une diminution de la consommation de lait (Martin, 1986).
Selon une étude, un chaton ayant été privé de sa mère et de ses frères durant les 23 premiers jours de sa vie est capable, suite parfois à un court délai, de trouver les mamelles et d’initier la tétée. Au-delà, cela devient plus difficile. Ainsi, le comportement de tétée semble dépendre des réflexes innés pendant les trois premières semaines, mais sa persistance semble, elle, dépendre de l’apprentissage (Kovach et Kling, 1967).
Le chaton à cette période tête toutes les 4 à 6h, chaque tétée pouvant durer jusqu’à 45 minutes (Beaver, 1992).
Sommeil
Comportement de jeu et de prédation
Le jeu a plusieurs intérêts. Il permet un entrainement physique musculaire mais aussi l’amélioration de la coordination et de l’équilibre. De plus, le jeu assure l’exploration de l’environnement et des contacts sociaux entre congénères. On distingue différents types de jeux en fonction de l’objet vers lequel le jeu est dirigé : jeux sociaux (impliquant un autre chat), jeux avec des objets, jeux de prédation.
- Jeux avec les objets
Vers 2 semaines, l’intérêt pour des objets en mouvement commence à apparaître. Ce jeu se développe avec la coordination musculaire. Le saut se développe à des stades très différents selon les chatons : il apparaît entre 17 et 43 jours de vie (Beaver, 1992).
- Jeux sociaux
Les jeux sociaux ne s’observent que très peu encore à cette période (Beaver, 1992). Certains comportements, parmi les 8 associés aux jeux sociaux (voir « De 1 mois à 45 jours »), commencent à apparaitre :
- Le «belly-up » : le chaton est sur le dos et montre son ventre tout en jouant avec les pattes et la bouche. Ce comportement est visible pour la première fois aux alentours de 21 à 23 jours.
- Le « stand-up » : le chaton est assis et joue avec ses membres antérieurs avec un congénère qui se trouve, lui, sur le dos. Il apparaît vers 23 jours (Beaver, 1992).
- Jeux de prédation
Les jeux de prédation ne sont pas encore présents (Beaver, 1992).
Communication verbale
Système neurologique
Capacités sensorielles
- Vision
Aux alentours de J20, ils reconnaissent leur mère à sa silhouette, en plus de son odeur (Bradshaw et al., 2012). Le chaton est maintenant capable de s’orienter grâce à sa vision vers une cible. Les yeux sont ouverts mais les liquides optiques continuent à s’éclaircir. Le fond de l’œil est totalement visible entre 27 et 38 jours après la naissance. Sa couleur n’est cependant pas encore celle de l’adulte (Villablanca et Olmstead, 1979).
Les réflexes liés à la vision sont décrits un peu plus loin.
- Audition
Les pavillons auriculaires bougent de façon plus discrète, de façon semblable à celle de l’adulte. Ils présentent leur configuration définitive à 1 mois (Olmstead et Villablanca, 1980). Le chaton distingue à présent clairement les différentes vocalisations. Sa réponse est adaptée en fonction de la nature du stimulus auditif. Par exemple, il est attiré par celles provenant de sa mère ou de ses frères et sœurs, tandis qu’il s’éloigne de celles provenant de chats mâles (Olmstead et Villablanca, 1980 ; Bradshaw et al., 2012). Le chaton localise avec précision la localisation des sons à environ 26 jours (Olmstead et Villablanca, 1980).
Ainsi, une semaine après l’ouverture de son canal auditif, le chaton est à présent capable d’orienter précisément ses pavillons auriculaires dans la direction du son, et de réagir en fonction de la nature de celui-ci.
- Olfaction
L’olfaction est présente et s’affine progressivement (Beaver, 1980).
- Goût et toucher
Le goût et le toucher sont présents (Bradshaw et al., 2012).
Thermorégulation
Jusqu’à J25, le chaton reste blotti dans le nid avec ses frères et sœurs. A partir de J25, les chatons commencent à sortir du nid. Ils sont capables de maintenir leur température corporelle lorsqu’ils sont sortis du nid, bien qu’à un niveau plus bas que la température de l’adulte (entre 37 et 38,2°C) (Olmstead et al., 1979).
A J20, le chaton a développé le frisson thermique lorsqu’il est exposé au froid. La pilo-érection qui accompagne le frisson est également observable à cet âge (Olmstead et al., 1979).
Réactions posturales
Ce sont des actions volontaires déclenchées qui nécessitent une coordination entre le système sensoriel, la moelle épinière et les motoneurones centraux et périphériques. Leur évaluation permet d’apprécier la symétrie de développement des fonctions neurologiques chez le chaton. Leur maturation chez le chaton de 30 jours est reportée dans le Tableau 54.
Tableau 54 : Bilan des réactions posturales chez le chaton à 1 mois d’âge (Villablanca et Olmstead, 1979 ; Sechzer et al., 1984 ; Hoskins, 1990). M = réaction mature ; I = réaction immature ou en cours de maturation ; A = réaction absente.
| Placer proprioceptif | M |
| Placer tactile | I |
| Sautillement | I |
| Placer du menton | I/M |
| Placer visuel | I |
| Hémilocomotion | I |
| Réaction de soutien du corps | M |
Réflexes moteurs
Il s’agit de réactions involontaires déclenchées artificiellement. Un réflexe diminué (hyporéflexie) ou absent (aréflexie) indique une anomalie des fibres sensitives segmentaires et/ou des motoneurones périphériques. Un réflexe augmenté (hyperréflexie) peut montrer une anomalie au niveau des motoneurones centraux. L’évaluation des réflexes sur un chaton est compliquée, de part une hétérogénéité dans leur développement et une difficulté de mise en évidence (Hoskins, 1990). Leur présence ou non chez le chaton de 30 jours est reportée dans le Tableau 55.
Tableau 55 : Bilan des réflexes moteurs chez le chaton à 1 mois d’âge (Hoskins, 1990). P = réflexe présent ; A = réflexe absent.
| Réflexe patellaire | P |
| Réflexe de l’extenseur radial du carpe | P |
| Réflexe de flexion | P |
| Réflexe d’extension croisée | A |
| Réflexes toniques du cou | A |
Réflexes liés à une stimulation tactile
Les réflexes tactiles sont à l’origine des premières interactions du chaton avec sa mère. Pour cette période, ils sont reportés dans le Tableau 56.
Tableau 56 : Bilan des réflexes liés à une stimulation tactile chez le chaton à 1 mois d’âge (DeGroat et al., 1975 ; Beaver, 1980 ; Gagnon, 2012 ; Bradshaw et al., 2012). P = réflexe présent ; A = réflexe absent.
| Réflexe de tétée | A |
| Réflexe de fouissement | A |
| Réflexe d’immobilisation | P |
| Réflexe périnéal | A |
| Réflexe auriculo-naso-céphalique | A |
| Réflexe de Galant | A |
Réflexes liés à la vision
Le réflexe palpébral, les réflexe de clignements à la menace et à la lumière, le réflexe pupillaire et le réflexe cornéen sont présents et matures (Villablanca et Olmstead, 1979 ; Beaver, 1980). Un bilan de sréflexes liés à la vision chez le chaton de 30 jours est présenté dans le Tableau 57.
Tableau 57 : Bilan des réflexes liés à la vision chez le chaton à 1 mois d’âge (Villablanca et Olmstead, 1979 ; Beaver, 1980). P = réflexe présent ; A = réflexe absent.
| Réflexe palpébral | P |
| Réflexe pupillaire | P |
| Réflexe de clignement à la lumière | P |
| Réflexe de clignement à la menace | P |
| Réflexe cornéen | P |
Locomotion
A partir de 3 semaines, une marche rudimentaire apparait. A partir de 4 semaines, le chaton se tient sur ses 4 membres et se déplace de plus en plus loin du nid. Sa locomotion reste encore lente et incertaine (Sechzer et al., 1984).
Sang
Volémie
Le volume sanguin total du chaton est de 5 à 10 mL/100g de poids corporel, équivalent à celui du chat adulte (Von Dehn, 2014).
Système hématopoïétique
- La lignée rouge
L’hématie du chaton de 20 jours à 1 mois est sensiblement différente de celle du chat adulte. Tout d’abord, elle présente une macrocytose. En effet, son volume globulaire moyen (VGM) est plus élevé que celui de l’adulte (Tableau 58). Il diminue pour atteindre celui de l’adulte à l’âge de 1 mois, au moment où les hématies du nouveau-né sont remplacées par celles de l’adulte. De plus, elles sont produites en plus faible quantité et présentent une durée de vie plus courte que les hématies du chat adulte (66 à 79 jours chez le chaton contre 85 à 90 jours chez le chat adulte (Gauclère, 1993) . Ceci peut être à l’origine d’un dénombrement important de réticulocytes, de corps d’Howell-Jolly et de corps de Heinz lors de la réalisation d’une cytologie sanguine (Von Dehn, 2014).
L’hémoglobine est de structure identique à celle de l’adulte et possède une affinité semblable au dioxygène (Wellman, 2010).
L’hématocrite du chaton de 20 jours à 1 mois atteint les valeurs les plus basses à cette période (Tableau 58). Cette anémie physiologique est due à plusieurs facteurs : la production de globules rouges qui diminue, le volume sanguin qui augmente provoquant une hémodilution, la carence physiologique en fer due à la consommation de lait, la destruction des globules rouges fœtaux (Chandler, 2014).
Les paramètres sanguins relatifs aux hématies chez le chaton de 20 jours à 1 mois (hématocrite, hémoglobinémie, VGM, CCMH, TCMH et nombre d’hématies) sont reportés dans le Tableau 58.
Tableau 58 : Valeurs hématologiques moyennes de la lignée rouge chez le chaton de 2 à 4 semaines en bonne santé (Grundy, 2006) et chez l’adulte (Hébert, 2010). VGM : volume globulaire moyen ; CCMH : concentration corpusculaire moyenne en hémoglobine ; TCMH : teneur corpusculaire moyenne en hémoglobine.
| 2 à 4 semaines (moyenne ± écart-type) |
Adulte (intervalle de référence) |
|
| Hématocrite (%) | 26,5 ± 0,8 | 24-45 |
| Hématies (1012/L) | 4,67 ± 0,10 | 5,0-10,0 |
| Hémoglobine (g/dL) | 8,7 ± 0,2 | 8,0-15,0 |
| VGM (fL) | 53,9 ± 1,2 | 39-50 |
| CCMH (%) | 33,0 ± 0,5 | 32-36 |
| TCMH (pg) | 18,8 ± 0,8 | 13-17 |
- La lignée blanche
Les concentrations sanguines en granulocytes neutrophiles et lymphocytes chez le chaton de 20 jours à 1 mois sont dans les intervalles de référence de l’adulte (Tableau 59). La concentration en leucocytes est cependant dans les valeurs hautes des valeurs de l’adulte (Von Dehn, 2014). Le taux de granulocytes éosinophiles est légèrement supérieur aux normes adultes (Tableau 59).
Tableau 59 : Valeurs hématologiques moyennes de la lignée blanche chez le chaton de 2 à 4 semaines en bonne santé (Grundy, 2006) et chez l’adulte (Hébert, 2010).
| 2 à 4 semaines (moyenne ± écart-type) |
Adulte (intervalle de référence) |
|
| Leucocytes (109/L) | 15,31 ± 1,21 | 5,5-15,4 |
| Neutrophiles non segmentés (109/L) | 0,11 ± 0,04 | 18,6-40 |
| Neutrophiles segmentés (109/L) | 6,92 ± 0,77 | 2,0-22,3 |
| Lymphocytes (109/L) | 6,56 ± 0,59 | 1,5-7,0 |
| Monocytes (109/L) | 0,02 ± 0,02 | 0,0-0,85 |
| Eosinophiles (109/L) | 1,41 ± 0,16 | 0,0-0,75 |
| Basophiles (109/L) | 0 | 0,0-0,2 |
- Les protéines plasmatiques
Albumine
Entre 20 jours et 1 mois de vie, la concentration en albumine plasmatique du chaton est plus faible qu’à l’âge adulte (Tableau60).
Tableau 60 : Concentration sanguine en albumine chez le chaton de 20 jours à 1 mois (Hoskins, 1990 ; Von Dehn, 2014) et chez le chat adulte (Hébert, 2010).
| 2 à 4 semaines (Von Dehn, 2014) (intervalle de référence) |
4 semaines (Hoskins, 1990) (intervalle de référence) |
Adulte (intervalle de référence) |
|
| Albumine (g/L) | 22-24 | 24-49 | 24-35 |
Protéines totales
La concentration en protéines totales est plus faible qu’à l’âge adulte (Tableau 61). Le foie, encore immature, est incapable de compenser l’expansion rapide du volume plasmatique post-natale en produisant suffisamment de protéines (Hoskins, 1990).
Tableau 61 : Concentration sanguine en protéines totales chez le chaton de 20 jours à 1 mois (Hoskins, 1990 ; Levy et al., 2006) et chez le chat adulte (Hébert, 2010).
| 2 à 4 semaines (Levy et al., 2006) (intervalle de référence) |
4 semaines (Hoskins, 1990) (intervalle de référence) |
Adulte (intervalle de référence) |
|
| Protéines totales (g/L) | 46-52 | 45-56 | 53-85 |
Minéraux : calcium et phosphore
Ces deux minéraux sont présents en grande quantité dans le sang du chaton de 10 à 20 jours (Tableau 62).
Tableau 62 : Concentrations sanguines en calcium et phosphore chez le chaton à 1 mois d’âge (Levy et al., 2006) et chez le chat à l’âge adulte (Hébert, 2010).
| 1 mois (intervalle de référence) |
Adulte (intervalle de référence) |
|
| Calcium (mmol/L) | 2,5-3,0 | 2,1-2,9 |
| Phosphore (mmol/L) | 2,2-2,9 | 1,2 -3,0 |
Glucose
La glycémie du chaton entre 20 jours et 1 mois post-partum est reportée dans le Tableau 63.
Tableau 63 : Concentration sanguine en glucose chez le chaton à 1 mois d’âge (Levy et al., 2006) et chez le chat adulte (Hébert, 2010).
| 1 mois (intervalle de référence) |
Adulte (intervalle de référence) |
|
| Glucose (mmol/L) | 6,5-8,4 | 2,6-8,4 |
Cholestérol et triglycérides
La cholestérolémie et la triglycéridémie sont régies par la production hépatique de cholestérol et par l’absorption intestinale de lipides. Le chaton de 20 jours à 1 mois présente une fonction hépatique immature. Cependant, il se nourrit encore en grande partie de lait, substance très riche en lipides (Gorman, 2011). A cette période, la cholestérolémie et la triglycéridémie sont supérieures aux normes de l’adulte chez le chat (Tableau 64).
Tableau 64 : Concentrations sanguines en cholestérol et en triglycérides chez le chaton à 1 mois d’âge (Levy et al., 2006) et chez le chat adulte (Hébert, 2010).
| 1 mois (intervalle de référence) |
Adulte (intervalle de référence) |
|
| Cholestérol (mmol/L) | 4,4-6,5 | 2,0-3,4 |
| Triglycérides (mmol/L) | 0,49-8,1 | 0,57-1,1 |
Créatine kinase
La CK (Créatinine Kinase) est une enzyme qui signe une détérioration cellulaire du myocarde ou d’une rhabdomyolyse. Sa valeur à la naissance est très élevée par rapport aux valeurs de l’adulte, du fait du traumatisme subit au moment de la mise-bas par le chaton (Tableau 65).
Tableau 65 : Concentration sanguine en créatinine kinase chez le chaton à 1 mois d’âge (Levy et al., 2006) et chez le chat adulte (Hébert, 2010).
| 1 mois (intervalle de référence) |
Adulte (intervalle de référence) |
|
| CK (UI/L) | 125-592 | 0-820 |
Paramètres hépatiques
Paramètres rénaux
Système immunitaire
Organes hématopoïétiques
Entre 20 et 30 jours de vie, la rate n’a plus de fonction hématopoïétique mais exerce une fonction érythroclastique de destruction des hématies vieillissantes. Toutefois, le potentiel hématopoïétique du foie et de la rate pourra se réactiver en cas de besoin. L’hématopoïèse se a lieu dans la moelle osseuse. Le thymus, siège de la différenciation et maturation des lymphocytes T, continue et achève sa croissance (Chabanne, 2006).
Réponse immunitaire
Entre 20 et 30 jours de vie, le système immunitaire du chaton est encore immature. Il construit progressivement son répertoire de cellules mémoires, en fonction des contacts avec son environnement et ses congénères.
Sa réponse immunitaire est majoritairement de type primaire, d’intensité plus modérée et plus lente à se mettre en place qu’une réponse secondaire. Il est également déficitaire en éléments de l’immunité spécifique (leucocytes, enzymes, facteurs du complément). Concernant cette dernière, les lymphocytes B, assurant l’immunité à médiation humorale, se développent dans la moelle osseuse. Ils sont ensuite distribués dans les tissus lymphoïdes secondaires, et notamment les nœuds lymphatiques et la rate. La prolifération de lymphocytes T, assurant l’immunité à médiation cellulaire, augmente entre J20 et J30 (Person, 2003).
Anticorps d’origine maternelle
La protection du chaton de J10 à J20 est assurée par des anticorps d’origine maternelle. Lorsque la prise de colostrum a été correcte, le nouveau-né possède un taux d’IgG sérique équivalent à celui de sa mère.
L’immunité passive locale apparaît progressivement au cours du développement du chaton. Elle est constituée par les IgA et les IgG contenues dans le lait, dont les concentrations sont au plus bas : environ 3 g/L pour les IgG et 0.3g/L pour les IgA. Dans le tube digestif, les IgA résistent à la digestion protéique, contrairement aux IgG. La paroi intestinale étant imperméable à cet âge-là, les immunoglobulines ingérées participent à l’immunité locale uniquement.
A cet âge, compte tenu de la durée de vie des anticorps dirigés contre les principaux agents pathogènes, le chaton âgé de 20 à 30 jours est encore protégé contre les maladies associées à ces derniers par les anticorps maternels (Tableau 66).
Tableau 66 : Demi-vie des immunoglobulines G maternelles chez les chatons nouveau-nés et durée de protection moyenne contre les principales maladies (Gauclère, 1993). NB : la durée de protection n’est qu’indicative, elle dépend du statut vaccinal de la mère.
| Agent pathogène | Demi-vie des IgG (jours) | Durée de protection (semaines) |
| Feline Parvovirus FPV | 9,5 | 8-14 |
| FeLV | 15 | 6-8 |
| Herpès-virus FHV | 18,5 | 6-8 |
| Calicivirus FCV | 15 | 9-14 |
| Coronavirus FCoV | 7 | 4-6 |
| Lyssavirus de la rage | ? | 13 |
| Chlamydophila felis | ? | 8-12 |
Ainsi, dans l’hypothèse où la prise colostrale a été correcte et où le calendrier vaccinal de la mère a été respecté, le chaton de 20 à 30 jours se trouve encore protégé contre les principales maladies : panleucopénie, leucose, herpèsvirose, calicivirose, coronavirose, rage et chlamydiose (Tableau 66).
Conséquences sur la vaccination et calendrier vaccinal
Jour 30 à Jour 45

Croissance
- Calcul du poids idéal grâce au gain moyen quotidien :
La croissance d’un individu est reflétée par son gain moyen quotidien, exprimé en grammes par jour. Il est calculé comme suit :
GMQ Ja – Jb = (P Jb – P Ja) / (a – b)
Cet indice peut être exprimé en pourcentage du poids au jour a (Ja). Il est important de s’assurer qu’il a des valeurs positives. Le poids du chaton de 30 à 45 jours ne doit en effet pas stagner plus de 24 heures et doit augmenter chaque jour (Hoskins, 1990).
- Courbe de croissance :
La littérature fournit des objectifs de croissance. Gast a réalisé une courbe de croissance grâce au suivi de 370 chatons en bonne santé (Figure 5), nous permettant de visualiser l’allure de celle-ci entre 30 et 45 jours de vie. Néanmoins, la croissance du chaton entre 30 et 45 jours de vie varie en fonction du sexe, de la taille de la portée, du poids de naissance (Gast, 2011). Selon Dubos, le chaton mâle de 6 semaines pèse en moyenne 625 g, tandis que le chaton femelle pèse en moyenne 534 g.
Figure 5 : Poids moyen (avec IC 95 %) (en grammes) des chatons « en bonne santé » au cours de la croissance et grossissement sur la période entre 30 et 45 jours de vie (Gast, 2011).
Système cardio-vasculaire
Anatomie cardio-vasculaire
Le ratio des masses des ventricules droit et gauche d’un chat adulte est atteint : il est de 1/3, le ventricule gauche étant trois fois plus lourd que le droit. La croissance des deux ventricules est ensuite symétrique (McIntosh Bright et Holmberg, 1990).
Le foramen ovale est fermé de façon fonctionnelle, il est susceptible de se rouvrir sous l’effet d’une modification du taux d’oxygène dans le sang ou de l’équilibre acido-basique, lors d’une infection respiratoire par exemple (Voldoire, 2002). La date de sa fermeture définitive n’est pas citée dans la littérature.
Fonction cardiaque
- Auscultation
Fréquence et rythme cardiaques
L’auscultation du cœur est difficile du fait de la taille du thorax et de la fréquence de battements élevée. Elle doit se réaliser à gauche, au niveau de l’apex cardiaque, entre le cinquième et le sixième espace intercostal, dans le tiers ventral du thorax. L’usage d’un stéthoscope pédiatrique est conseillé (Root Kustritz, 2011).
La fréquence cardiaque normale d’un chaton de 1 mois à 45 jours est d’environ 180 ± 30 battements par minute (bpm) (Lourenço et Ferreira, 2003).
Le rythme cardiaque est un rythme cardiaque sinusal régulier chez le chaton de moins de 6 semaines (McIntosh Bright et Holmberg, 1990).
Souffles physiologiques
Des souffles cardiaques de grades 1/6 à 3/6 entendus chez les chatons de 1 mois à 45 jours sont le plus souvent causés par le flux sanguin aortique ou pulmonaire rapide ou des délais variables de fermeture des shunts intracardiaques ou entre le cœur et les grands vaisseaux (Root Kustritz, 2011). Les souffles de grades 4/6 à 6/6 sont généralement dus à des malformations cardiaques congénitales. Les plus fréquentes chez le chat sont la dysplasie de la valve tricuspide et l’aplasie du septum ventriculaire (Root Kustritz, 2011).
- Electrocardiogramme
L’électrocardiographie (ECG) permet de détecter des arythmies ou des défauts de conductions. L’onde P présente une amplitude et durée semblables à celles de l’adulte. La durée et l’amplitude du complexe QRS et des intervalles PR et QT le sont également, ainsi que la durée de l’onde R (Lourenço et Ferreira, 2003).
- Pression artérielle
La pression artérielle du chaton de 1 mois à 45 jours est comprise entre 40 à 50 mmHg. Ces faibles valeurs sont dues aux parois musculaires artérielles immatures et à une faible résistance artérielle périphérique. A cet âge, l’analyse des variations de la pression sanguine ne permet pas de diagnostiquer un choc hypovolémique (Giry, 2002).
- Adaptabilité cardiaque
Le chaton de 1 mois à 45 jours présente un débit cardiaque, un volume plasmatique, une pression veineuse centrale et une post-charge plus élevés que chez l’adulte (McIntosh Bright et Holmberg, 1990). Au contraire, la pression artérielle moyenne, le volume d’éjection systolique, la résistance vasculaire périphérique et la précharge sont plus faibles (McIntosh Bright et Holmberg, 1990). La masse myocardique contractile et la compliance ventriculaire (capacité des ventricules à se dilater) sont également plus faibles. Ainsi, la réserve cardiaque est faible et le volume d’éjection systolique ne varie pas (Giry, 2002). Le débit cardiaque du chaton (DC = VES x FC avec DC : Débit cardiaque (L/min ; VES : Volume d’éjection systolique (L) ; FC : Fréquence cardiaque (bpm)) ne dépend donc que de la fréquence cardiaque (McIntosh Bright et Holmberg, 1990).
Ainsi, le cœur du chaton a une très faible capacité d’adaptation en fonction des évènements (repos/exercice). De plus, le contrôle nerveux de la fréquence cardiaque est mauvais chez le chaton de 1 mois à 45 jours. Leur myocarde est moins dense en fibres sympathiques. Jusque-là, le cœur du chaton est incapable notamment de répondre à une hypovolémie par une tachycardie. Ainsi, le chaton est sensible aux pertes sanguines, même peu importantes (5-10 mL/kg). Ceci est à prendre en compte lors de prélèvements sanguins notamment (ils ne doivent pas excéder 0,5 mL pour 100 g de poids) (McIntosh Bright et Holmberg, 1990).
Système respiratoire
Anatomie et physiologie de l’arbre respiratoire
Les poumons poursuivent leur développement entre 30 et 45 jours (Root Kustritz, 2011) et le système respiratoire atteint une efficacité proche de l’adulte. Les ramifications de l’arbre respiratoire sont formées mais leur morphologie évolue encore (Giry, 2002). Les voies respiratoires, plus souples que chez l’adulte, continuent de se rigidifier. Bien que la résistance à l’écoulement de l’air et les risques d’obstruction diminuent, l’effort respiratoire reste plus intense qu’à l’âge adulte. La cage thoracique du chaton subit le même sort : elle s’ossifie peu à peu et le mouvement respiratoire devient plus aisé (Giry, 2002).
Les besoins en oxygène du chaton de 30 à 45 jours diminuent pour se rapprocher de ceux de l’adulte (Voldoire, 2002). Quant à la fréquence respiratoire, elle est de 20 à 36 mpm la quatrième semaine (Grellet, 2010). Elle diminue ensuite pour atteindre celle d’un chat adulte aux alentours de 15 semaines d’âge (Gauclère, 1993). Le chaton présente une amplitude respiratoire et une réserve pulmonaire plus faibles que l’adulte (Root Kustritz, 2011 ; Moon et al., 2001).
Le chaton nouveau-né se voit donc forcé de fournir un effort respiratoire supérieur à celui de l’adulte, alors que sa résistance à la fatigue musculaire est réduite (Moon et al., 2001). Tout ceci doit être pris en compte lors de l’examen clinique de la fonction respiratoire.
Réponse physiologique face à l’hypoxie
Le chaton entre un mois et 45 jours présente une réponse à l’hypoxie semblable à celle de l’adulte (Moon et al., 2001).
Le signe caractéristique d’affection respiratoire chez le chaton nouveau-né est la dyspnée ou détresse respiratoire (Root Kustritz, 2011). La détresse respiratoire se manifeste par une fréquence, des efforts et/ou des bruits respiratoires augmentés, une intolérance à l’effort ou un collapsus pulmonaire aigu (Root Kustritz, 2011). L’halètement est un signe de température augmentée normal chez le chien alors que chez le chaton, il est dans la majorité des cas associé à une détresse respiratoire significative. La respiration bouche ouverte est, elle, considérée comme pathologique chez le chiot et le chaton (Root Kustritz, 2011).
Système digestif
Les dents
A 30 jours, le chaton possède normalement déjà toutes ses incisives (101/102/103/, 201/202/203, 301/302/303 et 401/402/403) et ses canines déciduales (104, 204, 304 et 404). Entre 4 et 6 semaines d’âge, les prémolaires 3 et 4 déciduales (107/108, 207/208, 307/308 et 407/408) font éruption (Hoskins, 1990).
Le chat ne possède pas de prémolaire PM1 dans sa dentition déciduale, ni dans sa dentition permanente. Il ne possède pas de molaire M1 dans sa dentition déciduale (Hoskins, 1990).
Le tube digestif
L’ingestion de lait diminue proportionnellement au poids corporel. Parallèlement, l’ingestion d’aliment solide augmente (Peterson et Kutzler, 2011).
La taille de l’estomac, et par conséquent la capacité d’ingestion, ont augmenté considérablement avec l’introduction d’aliments solides. La paroi intestinale est épaisse. La quantité de suc gastrique et d’enzymes digestives sécrétés par l’estomac tend à diminuer avec l’âge (proportionnellement au poids corporel). L’activité de la pepsine augmente (Zabielski et al., 1999).
Le pancréas
La flore bactérienne
La digestion
- Digestion des protéines
Entre J30 et J45, le sevrage du chaton est en cours. Le lait représente encore une grande partie du régime du chaton. D’autre part, il accueille progressivement l’alimentation solide. Etant un carnivore, les protéines occupent une place très importante dans son alimentation. L’activité de la pepsine augmente parallèlement à la diminution progressive du pH stomacal (Harper et Turner, 2000).
- Digestion des glucides
Pendant cette période, la prise de lait diminue, tandis que l’alimentation solide devient dominante. Le lactose, qui fait partie des principales sources d’énergie du lait, est fractionné en glucose et galactose par une enzyme : la lactase. L’amylase, la maltase, la saccharase et la lactase sont actives dans l’intestin grêle. Ils sont transformés en oses comme le glucose. La microflore du gros intestin se développe pour assurer une partie de la digestion des glucides, les transformant en acides gras volatils. Les oses à longue chaine sont digérés également. En effet, l’activité de l’alpha-amylase augmente peu à peu. A 45 jours, la digestibilité de l’amidon cuit est de 78,5 % (Wolter, 2011).
- Digestion des lipides
La lipase pancréatique permet la digestion intestinale des lipides issus de l’alimentation solide. L’efficacité de la digestion des lipides augmente entre 30 et 45 jours de vie (Harper et Turner, 2000).
Les paramètres biochimiques de la fonction hépatique
Système urinaire
Fonction émonctoire du rein
- Filtration glomérulaire et réabsorption tubulaire
La néphrogenèse est terminée. Le débit de filtration glomérulaire à cette période continue d’augmenter mais ne correspond encore qu’à environ 50 % de celui de l’adulte en raison d’une pression artérielle faible et d’un épithélium glomérulaire peu perméable (Fettman et Allen, 1991).
De même, la réabsorption tubulaire du chaton de 1 mois à 45 jours est encore partiellement immature, ce qui implique plusieurs faits. Le premier est que la capacité de concentration des urines est moins développée que chez l’adulte. Ainsi, ces dernières sont 1,5 fois plus concentrées que le sang chez le chaton de 1 mois à 45 jours contre 4 à 5 fois chez le chat adulte et sa densité urinaire est inférieure à 1.020 (Little, 2011). Ensuite, la réabsorption des molécules organiques par les tubules est encore immature. Les concentrations urinaires en protéines, glucose et acides aminés sont plus élevées chez le chaton de 1 mois à 45 jours que chez l’adulte (Fettman et Allen, 1991). Le ratio protéines sur créatinine urinaire (RPCU) est semblable à celui de l’adulte. De même, la clairance rénale de la créatinine est d’environ 1,39 à 3,59 mL/min/kg, contre 3,80 à 4,74 mL/min/kg chez le chaton de 9 à 19 semaines (Dial, 1992). La sécrétion tubulaire est pleinement efficace entre 4 et 8 semaines (Fettman et Allen, 1991).
- Conséquences sur l’utilisation de médicaments en pratique
L’immaturité rénale est à prendre en compte lors de l’administration de médicaments excrétés ou métabolisés par les reins. En effet, leur clairance rénale est diminuée, ce qui peut induire des effets secondaires indésirables comme une néphrotoxicité ou une augmentation de leur durée d’action. C’est le cas notamment de la kétamine et de certains antibiotiques (céphalosporines, pénicillines, tétracyclines, trimétoprimes-sulfates) (Dial, 1992). L’antibiotique de choix cité par les auteurs est généralement le ceftiofur (2,5 mg/kg par voie sous-cutanée toutes les 12 heures pendant un maximum de 5 jours). L’utilisation d’anti- inflammatoires non stéroïdiens chez le chaton de 1 mois à 45 jours est déconseillée du fait de leur toxicité rénale accrue chez ce sujet (Grundy, 2006).
- Paramètres biochimiques de la fonction rénale
La créatininémie
La créatininémie est plus faible qu’à l’âge adulte : 0,2 à 1,2 mg/dL de sang chez un chaton de 4 à 6 semaines en bonne santé. Ceci peut en partie être expliqué par une masse musculaire proportionnellement plus faible que l’adulte (Tableau 68).
Tableau 68 : Créatininémie du chaton entre 1 mois et 45 jours de vie (Giry, 2002 ; Levy et al., 2006) et du chat adulte (Hébert, 2005).
L’urémie
L’urémie chez le chaton dépend de l’alimentation et de la durée du jeûne (temps écoulé entre le dernier repas et le prélèvement sanguin). En moyenne, sa valeur est comprise entre 0,32 et 0,77 mg/dL de sang chez le chaton de 4 à 6 semaines en bonne santé (Tableau 69).
Tableau 69 : Urémie du chaton entre 1 mois et 45 jours de vie (Giry, 2002 ; Levy et al., 2006) et du chat adulte (Hébert, 2005).
Régulation hydrique et conséquences en pratique
Les besoins hydriques du chaton de moins de 2 mois sont estimés à 120 à 180 mL par kg de poids corporel, donc plus importants que l’adulte (50 à 100 mL/kg). Ceci est dû à une plus forte teneur en eau dans son organisme (80 % contre 60 % pour le chat adulte), un rapport surface sur poids corporel plus important (donc des pertes par déshydratation plus importantes), un métabolisme plus rapide et une masse graisseuse plus faible que l’adulte.
Le chaton de 1 mois à 45 jours est sensible à toute modification du volume liquidien extracellulaire (suite à une diarrhée, des vomissements ou un jeûne). Il est sujet à une déshydratation rapide (Fettman et Allen, 1991), mais celle-ci est difficile à évaluer. Le test du pli de peau n’est pas significatif avant 6 semaines, puisque la peau du chaton contient moins de graisse et plus d’eau que celle du chat adulte. L’humidité des muqueuses est facilement évaluable et est un reflet de l’état d‘hydratation (Moon et al., 2001).
Si le chaton à cet âge-là tolère mal la déshydratation, il est tout aussi sensible à une fluidothérapie excessive ou mal adaptée d’un point de vue électrolytique. Cette dernière peut être à l’origine d’une surcharge cardiovasculaire, un œdème pulmonaire et des hémorragies intracrâniennes.
Miction
Comportement
Comportement alimentaire
Un chaton ayant été privé de sa mère et de ses frères durant les 35 premiers jours de sa vie est incapable de trouver les mamelles et d’initier la tétée. Ceci peut être relié à la disparition du réflexe de succion au cours de la 4ème semaine de vie. Ainsi, le comportement de tétée semble dépendre des réflexes innés pendant les trois premières semaines, mais sa persistance semble, elle, dépendre de l’apprentissage (Kovach et Kling, 1967).
A cette période, le chaton initie lui-même la tétée (Case, 2011). La mère prolonge progressivement les moments hors du nid et refuse de plus en plus la tétée à ses chatons. Les temps d’allaitement se raréfient progressivement. C’est le début du processus de sevrage. C’est un processus lent et progressif aboutissant à la complète indépendance alimentaire du chaton. En parallèle, dès la 3ème semaine, la mère rapporte des proies mortes au nid, introduisant ainsi l’aliment solide dans le régime alimentaire de ses chatons. Vers la 5ème semaine, elle rapporte des proies vivantes. Elle les relâche dans le nid afin que les chatons chassent (Case, 2011).
Le chaton à cette période tête toutes les 4 à 6 heures jusqu’au sevrage (Beaver, 1992).
Sommeil
Comportement de jeu et de prédation
Le jeu a plusieurs intérêts. Il permet un entraînement physique musculaire mais aussi l’amélioration de la coordination et de l’équilibre. De plus, le jeu assure l’exploration de l’environnement et développe les contacts sociaux entre congénères. On distingue différents types de jeux : jeux sociaux (impliquant au moins un autre chat), jeux avec des objets, jeux de prédation.
- Jeux avec les objets
A l’âge de 4 semaines, le jeu avec des objets s’observe chez les chatons en même temps que la coordination musculaire se développe.
- Jeux sociaux
Vers 35 jours, on observe des positions propres à la chasse (position aplatie, cambrure de l’arrière train, préparation du saut, etc.). La lutte entre congénères n’apparait que vers 43 jours. Vers 48 jours de vie, le chaton commence à grimper sur les supports lors des courses- poursuites. Le saut se développe à des stades très différents selon les chatons : il apparait entre 17 et 43 jours de vie (Beaver, 1992).
Les jeux sociaux s’observent majoritairement entre 4 et 16 semaines. Les jeux sociaux sont caractérisés par huit comportements bien définis (Beaver, 1992) :
- Le « belly-up » : le chaton se met sur le dos et montre son ventre tout en jouant avec les pattes et la bouche. A 6 semaines, ce comportement occupe 13 % des jeux sociaux en
- Le « stand-up » : le chaton est assis et joue avec ses membres antérieurs avec un congénère qui se trouve, lui, sur le
- Un « side-step » : le chaton se déplace de profil autour d’un autre, avec une position arquée et la tête tournée vers lui. Ce jeu se développe aux alentours de 33 jours et occupe à 6 semaines 42 % du temps de jeu.
- Le « vertical stance » : le chaton se positionne debout sur ses membres postérieurs en position bipède. Ce comportement apparait vers 35 jours. Il n’occupe qu’une petite partie du
- Le comportement de chasse ou course poursuite apparaît entre 38 et 41
- Le « horizontal leap » : le chaton adopte la posture du side-step puis saute sur le côté. Cette posture apparaît vers 45 jours en
- Le « face-off » : deux chatons assis se font face, se regardent et en se penchent l’un vers l’autre, puis dirigent des coups de patte vers la face de l’autre (Beaver, 1992).
- Jeux de prédation
Vers la 5ème semaine, la mère rapporte des proies vivantes dans le nid. Elle les relâche dans le nid afin que les chatons les chassent et les tuent, en les aidant si nécessaire. Cette activité de jeu permet l’apprentissage du comportement de prédation (Case, 2011).
Communication verbale
Système neurologique
Capacités sensorielles
- Vision
Le chaton est capable de s’orienter grâce à sa vision. Les liquides optiques deviennent transparents 1 mois environ après l’ouverture des yeux (27 à 38 jours) (Villablanca et Olmstead, 1979). La vision en 3 dimensions commence à se développer (Bradshaw et al., 2012). La coordination entre les yeux et les membres se développent entre 35 et 42 jours de vie (Bradshaw et al., 2012).
Les réflexes liés à la vision sont décrits dans la partie « Réflexes liés à la vision ».
- Audition
Les pavillons auriculaires ont à présent leur configuration définitive (Olmstead et Villablanca, 1980). Le chaton distingue clairement les différentes vocalisations. Sa réponse est adaptée en fonction de la nature du stimulus auditif. Par exemple, il est attiré par celles provenant de sa mère ou de ses frères et sœurs, tandis qu’il s’éloigne oreilles baissées de celles provenant de chats mâles (Olmstead et Villablanca, 1980 ; Bradshaw et al., 2012). Le chaton localise avec précision la localisation des sons (Olmstead et Villablanca, 1980). Ainsi, le chaton est à présent capable d’orienter précisément ses pavillons auriculaires dans la direction du son, et de réagir en fonction de la nature de celui-ci.
- Olfaction
L’olfaction est présente dès la naissance et s’affine progressivement (Beaver, 1980).
L’olfaction voméro-nasale est la faculté de l’organe voméro-nasal à détecter des phéromones. Il est caractérisé par le signe du flehmen. Celui-ci apparaît vers 5 semaines (Kolb et Nonneman, 1975).
- Goût et toucher
Le goût et le toucher sont présents (Bradshaw et al., 2012).
Thermorégulation
Les chatons sortent du nid. Ils sont capables de maintenir leur température corporelle lorsqu’ils sont sortis du nid, bien qu’à un niveau plus bas que la température de l’adulte (entre 37,4 et 38,6 °C) (Olmstead et al., 1979).
Le chaton peut mettre en place le frisson thermique lorsqu’il est exposé au froid. La pilo-érection qui accompagne le frisson est également observable à cet âge. Durant la 5ème semaine de vie, le halètement reprend à une fréquence élevée (Olmstead et al., 1979).
Réactions posturales
Réflexes moteurs
Il s’agit de réactions involontaires déclenchées artificiellement. Un réflexe diminué (hyporéflexie) ou absent (aréflexie) indique une anomalie des fibres sensitives segmentaires et/ou des motoneurones périphériques. Un réflexe augmenté (hyperréflexie) peut montrer une anomalie au niveau des motoneurones centraux. L’évaluation des réflexes sur un chaton est compliquée, de part une hétérogénéité dans leur développement et une difficulté de mise en évidence (Hoskins, 1990). Leur présence ou non chez le chaton de 45 jours est reportée dans le Tableau 71.
Tableau 71 : Bilan des réflexes moteurs chez le chaton à 45 jours d’âge (Hoskins, 1990). P = réflexe présent ; A= réflexe absent.
Réflexes liés à une stimulation tactile
Les réflexes tactiles sont à l’origine des premières interactions du chaton avec sa mère.
Pour cette période, ils sont reportés dans le Tableau 72.
Tableau 72 : Bilan des réflexes liés à une stimulation tactile chez le chaton à 45 jours d’âge (DeGroat et al., 1975 ; Beaver, 1980 ; Gagnon, 2012 ; Bradshaw et al., 2012). P = réflexe présent ; A = réflexe absent.
Réflexes liés à la vision
Locomotion
A l’âge de 5 semaines, le chaton est capable de courir, tourner, sauter. Sa démarche est plus assurée. A l’âge de 6-7 semaines, le chaton présente toutes les caractéristiques de la locomotion de l’adulte (Sechzer et al., 1984).
Sang
Volémie
Le volume sanguin total du chaton est de 5 à 10 mL/100 g de poids corporel, équivalent à celui du chat adulte (Von Dehn, 2014).
Système hématopoïétique
- La lignée rouge
L’hématie du nouveau-né est remplacée par l’hématie du chat adulte à l’âge de 1 mois. Cette dernière possède un volume globulaire moyen plus faible que celle du nouveau-né (Tableau 74). Sa durée de vie est supérieure à celle-ci : 85 à 90 jours (Gauclère, 1993) .
Ensuite, l’hématocrite du chaton de 1 mois ayant atteint sa valeur la plus basse, il augmente ensuite (Tableau 74) (Giry, 2002 ; Von Dehn, 2014).
Les paramètres sanguins relatifs aux hématies chez le chaton de 1 mois à 45 jours (hématocrite, hémoglobinémie, VGM, CCMH, TCMH et nombre d’hématies) sont reportés dans le Tableau 74.
Tableau 74: Valeurs hématologiques moyennes de la lignée rouge chez le chaton de 4 à 6 semaines en bonne santé (Grundy, 2006) et chez l’adulte (Hébert, 2010).VGM : volume globulaire moyen ; CCMH : concentration corpusculaire moyenne en hémoglobine ; TCMH : teneur corpusculaire moyenne en hémoglobine.
- La lignée blanche
Les concentrations sanguines en leucocytes et granulocytes éosinophiles continuent d’augmenter au-dessus des valeurs de l’adulte entre 1 mois et 45 jours. Les concentrations sanguines en polynucléaires neutrophiles et en lymphocytes subissent une légère baisse pendant cette période (Tableau 75).
Tableau 75 : Valeurs hématologiques moyennes de la lignée blanche chez le chaton de 4 à 6 semaines en bonne santé (Grundy, 2006) et chez l’adulte (Hébert, 2010).
- Les protéines plasmatiques
Albumine
Le chaton de 1 mois à 45 jours possède une concentration en albumine plasmatique plus faible qu’à l’âge adulte (Tableau 76).
Tableau 76 : Concentration sanguine en albumine chez le chaton à 1 mois d’âge (Levy et al., 2006), entre 4 à 6 semaines (Moon et al., 2001) et chez le chat adulte (Hébert, 2010).
Protéines totales
La concentration en protéines totales est plus faible qu’à l’âge adulte (Tableau 77). Le foie, encore immature, est incapable de compenser l’expansion rapide du volume plasmatique post-natale en produisant suffisamment de protéines (Hoskins, 1990).
Tableau 77 : Concentration sanguine en protéines totales chez le chaton à 1 mois d’âge (Levy et al., 2006), entre 4 à 6 semaines (Moon et al., 2001) et chez le chat adulte (Hébert, 2010).
Minéraux : calcium et phosphore
Ces deux minéraux sont présents en grande quantité dans le sang du chaton de 1 mois à 45 jours (Tableau 78).
Glucose
Sa valeur chez le chaton de 1 mois à 45 jours est reportée dans le Tableau 79.
Cholestérol et triglycérides
Créatine kinase
La CK (Créatinine Kinase) est une enzyme qui signe une détérioration cellulaire du myocarde ou une rhabdomyolyse. Sa valeur à la naissance est très élevée par rapport aux valeurs de l’adulte, du fait du traumatisme subit au moment de la mise-bas par le chaton (Tableau 81).
Paramètres hépatiques
Voir système digestif.
Paramètres rénaux
Voir système urinaire.
Système immunitaire
Organes hématopoïétiques
Entre 30 et 45 jours de vie, la rate n’a plus de fonction hématopoïétique mais exerce une fonction érythroclastique de destruction des hématies vieillissantes. Toutefois, le potentiel hématopoïétique du foie et de la rate pourra se réactiver en cas de besoin. L’hématopoïèse a lieu dans la moelle osseuse. Le thymus, siège de la différenciation et maturation des lymphocytes T, atteint son poids relatif maximal entre 1 et 2 mois (Chabanne, 2006).
Réponse immunitaire
Entre 30 et 45 jours de vie, le système immunitaire du chaton construit progressivement son répertoire de cellules mémoires, en fonction des contacts avec son environnement et ses congénères.
Sa réponse immunitaire est majoritairement de type primaire, d’intensité plus modérée et plus lente à se mettre en place qu’une réponse secondaire. Il est également déficitaire en éléments de l’immunité spécifique (leucocytes, enzymes, facteurs du complément). Concernant cette dernière, les lymphocytes B, assurant l’immunité à médiation humorale, se développent dans la moelle osseuse. Ils sont ensuite distribués dans les tissus lymphoïdes secondaires, et notamment les nœuds lymphatiques et la rate. La prolifération de lymphocytes T, assurant l’immunité à médiation cellulaire, augmente entre J30 et J45 (Person, 2003).
Anticorps d’origine maternelle
La protection du chaton de J30 à J45 est assurée par des anticorps d’origine maternelle. Elle est constituée par les IgA et les IgG contenues dans le lait, dont les concentrations sont au plus bas : environ 3 g/L pour les IgG et 0.3 g/L pour les IgA. Dans le tube digestif, les IgA résistent à la digestion protéique, contrairement aux IgG. La paroi intestinale étant imperméable à cet âge-là, les immunoglobulines ingérées participent à l’immunité locale uniquement.
A cet âge, compte tenu de la durée de vie des anticorps dirigés contre les principaux agents pathogènes, le chaton âgé de 30 à 45 jours, même s’il a bénéficié d’un transfert de bonne qualité, rentre dans une phase critique pour certains agents pathogènes. En effet, la protection d’origine maternelle contre le coronavirus félin n’agit plus à partir de 4 à 6 semaines (Tableau 82).
Tableau 82 : Demi-vie des immunoglobulines G maternelles chez les chatons nouveau-nés et durée de protection moyenne contre les principales maladies (Gauclère, 1993). NB : la durée de protection n’est qu’indicative, elle dépend du statut vaccinal de la mère.
Ainsi, dans l’hypothèse où la prise colostrale a été correcte et où le calendrier vaccinal de la mère a été respecté, le chaton de 30 à 45 jours se trouve encore protégé contre les principales maladies : panleucopénie, leucose, herpèsvirose, calicivirose, rage et chlamydiose (Tableau 82).
Conséquences sur la vaccination et calendrier vaccinal
A cet âge-là, les chatons ayant ingéré le colostrum de leur mère vaccinée sont protégés tant que les anticorps maternels persistent. Ces derniers protègent le chaton contre l’agent infectieux mais provoquent encore des interférences vaccinales durant 6 à 16 semaines après la naissance. En effet, ils induisent une neutralisation des antigènes vaccinaux et inhibent donc le développement de la réponse immunitaire. Les vaccinations ne sont donc pas efficaces tant que les taux d’anticorps maternels sont élevés. La vaccination devrait être effectuée lorsque ces taux sont proches du seuil d’interférence vaccinale. Cependant, l’absence de vaccination laisserait le chaton sans protection pendant la période de transition entre immunité passive et compétence immunitaire, période qui varie en fonction du statut immunitaire de la mère et du taux d’anticorps nécessaire à la neutralisation de l’agent infectieux (Bergues et Bertagnoli, 2003).
Ainsi, il est recommandé de commencer un protocole de vaccination à partir de six semaines en milieu exposé. Les injections peuvent alors être renouvelées toutes les deux à trois semaines jusqu’à l’âge de douze semaines.
Jour 45 à Jour 60

Croissance
- Calcul du poids idéal grâce au gain moyen quotidien :
La croissance d’un individu est reflétée par son gain moyen quotidien, exprimé en grammes par jour. Il est calculé comme suit :
GMQJa-Jb = (PJb – PJa) / (a–b)
Cet indice peut être exprimé en pourcentage du poids au jour a (Ja). Il est important de s’assurer qu’il a des valeurs positives. Le poids du chaton de 45 à 60 jours ne doit en effet pas stagner plus de 24h et augmenter chaque jour (Hoskins, 1990).
- Courbe de croissance :
La littérature fournit des objectifs de croissance. Gast a réalisé une courbe de croissance sur 370 chatons en bonne santé (Figure 6), nous permettant de visualiser l’allure de celle-ci entre 30 et 45 jours de vie. Néanmoins, la croissance du chaton entre 45 et 60 jours de vie varie en fonction du sexe, de la taille de la portée, du poids de naissance (Gast, 2011). Selon Dubos, le chaton mâle pèse en moyenne 625g à 6 semaines et 1kg à 8 semaines, tandis que le chaton femelle pèse en moyenne 534g à 6 semaines et 950g à 8 semaines. Par ailleurs, le poids à la naissance aurait un effet à long terme : un chaton léger à la naissance ne rattraperait son retard qu’à 8 semaines d’âge (Dubos, 1997).
Figure 6 : Poids moyen (avec IC 95%) (en grammes) des chatons en bonne santé au cours de la croissance et grossissement sur la période entre 45 et 60 jours de vie (Gast, 2011).
Système cardio-vasculaire
Anatomie cardio-vasculaire
Le ratio des masses des ventricules droit et gauche d’un chat adulte est atteint : il est de 1/3, le ventricule gauche étant trois fois plus lourd que le droit. La croissance des deux ventricules est ensuite symétrique (McIntosh Bright et Holmberg, 1990).
Le foramen ovale est fermé de façon fonctionnelle, il est susceptible de se rouvrir sous l’effet d’une modification du taux d’oxygène dans le sang ou de l’équilibre acido-basique, lors d’une infection respiratoire par exemple (Voldoire, 2002). La date de sa fermeture définitive n’est pas citée dans la littérature.
Fonction cardiaque
- Auscultation
Fréquence et rythme cardiaques
L’auscultation du cœur est difficile du fait de la taille du thorax et de la fréquence de battements élevée. Elle doit se réaliser à gauche, au niveau de l’apex cardiaque, entre le 5ème et le 6ème espace intercostal, dans le tiers ventral du thorax. L’usage d’un stéthoscope pédiatrique est conseillé (Root Kustritz, 2011).
La fréquence cardiaque normale d’un chaton de 45 jours à 2 mois est en moyenne de 208 battements par minute (bpm) (Lourenço et Ferreira, 2003).
A 8 semaines, l’absence d’arythmie sinusale respiratoire doit être considérée comme pathologique chez le chaton (contrairement au chiot) (McIntosh Bright et Holmberg, 1990).
Souffles physiologiques
souffles cardiaques de grades 1 à 3/6 entendus chez les chatons de 45 jours à 2 mois sont le plus souvent causés par le flux sanguin aortique ou pulmonaire rapide ou des délais variables de fermeture des shunts intracardiaques ou entre le cœur et les grands vaisseaux. Ils peuvent persister jusqu’à 4 mois (Root Kustritz, 2011). Les souffles de grades 4 à 6/6 sont généralement dus à des malformations cardiaques congénitales. Les plus fréquentes chez le chat sont la dysplasie de la valve tricuspide et l’aplasie du septum ventriculaire (Root Kustritz, 2011).
- Electrocardiogramme
L’électrocardiographie (ECG) permet de détecter des arythmies ou des défauts de conductions. Entre 45 jours et 2 mois, les durées et profils des ondes P, Q, R, S et T sont semblables à ceux de l’adulte (Lourenço et Ferreira, 2003).
- Pression artérielle
La pression artérielle du chaton de 45 jours à 2 mois est d’environ 50 mmHg. Elle augmente à partir de 6 semaines pour atteindre les valeurs de l’adulte au bout de plusieurs mois (120 à 160 mmHg). Ces faibles valeurs sont dues aux parois musculaires artérielles immatures et à une faible résistance artérielle périphérique. A cet âge-là, l’analyse des variations de la pression sanguine ne permet pas de diagnostiquer un choc hypovolémique (Giry, 2002).
- Adaptabilité cardiaque
Le chaton de 45 jours à 2 mois présente un débit cardiaque, un volume plasmatique, une pression veineuse centrale et une post-charge plus élevés que chez l’adulte (McIntosh Bright et Holmberg, 1990). Au contraire, la pression artérielle moyenne, le volume d’éjection systolique, la résistance vasculaire périphérique et la précharge sont plus faibles (McIntosh Bright et Holmberg, 1990). La masse myocardique contractile et la compliance ventriculaire (capacité des ventricules à se dilater) sont également plus faibles. Ainsi, la réserve cardiaque est faible et le volume d’éjection systolique ne varie pas (Giry, 2002). Le débit cardiaque du chaton (DC = VESxFC avec DC : Débit cardiaque (L/min) ; VES : Volume d’éjection systolique (L) ; FC : Fréquence cardiaque (bpm)) ne dépend donc que de la fréquence cardiaque (McIntosh Bright et Holmberg, 1990).
Ainsi, le cœur du chaton a une très faible capacité d’adaptation en fonction des évènements (repos/exercice). De plus, le contrôle nerveux de la fréquence cardiaque est mauvais chez le chaton de 45 jours à 2 mois. Leur myocarde est moins dense en fibres sympathiques. Le système nerveux autonome cardiaque ne sera complètement mature qu’après 8 semaines. Jusque là, le cœur du chaton est incapable notamment de répondre à une hypovolémie par une tachycardie. Ainsi, le chaton est sensible aux pertes sanguines, même peu importantes (5-10mL/kg). Ceci est à prendre en compte lors de prélèvements sanguins notamment (ils ne doivent pas excéder 0.5mL maximum pour 100g de poids) (McIntosh Bright et Holmberg, 1990).
Système respiratoire
Anatomie et physiologie de l’arbre respiratoire
Les poumons poursuivent leur maturation entre 45 et 60 jours (Root Kustritz, 2011). Les voies respiratoires et la cage thoracique se rigidifient, et l’effort respiratoire nécessaire diminue (Giry, 2002). Ce n’est qu’à la puberté que les poumons du chaton auront des capacités semblables à l’adulte.
Les besoins en oxygène du chaton de 45 à 60 jours diminuent pour se rapprocher de ceux de l’adulte (Voldoire, 2002). La fréquence respiratoire ralentit pour atteindre celle d’un chat adulte aux alentours de 15 semaines d’âge (Gauclère, 1993). Le chaton présente une amplitude respiratoire et une réserve pulmonaire plus faibles que l’adulte (Moon et al., 2001 ; Root Kustritz, 2011).
Le chaton nouveau-né fournit encore un effort respiratoire supérieur, alors que sa résistance à la fatigue musculaire est réduite par rapport à l’adulte (Moon et al., 2001). Tout ceci doit être pris en compte lors de l’examen clinique de la fonction respiratoire.
Le chaton entre 45 jours à 2 mois présente une réponse à l’hypoxie semblable à celle de l’adulte (Moon et al., 2001).
Le signe caractéristique d’affection respiratoire chez le chaton nouveau-né est la dyspnée ou détresse respiratoire. La détresse respiratoire se manifeste par une fréquence, des efforts et/ou des bruits respiratoires augmentés, une intolérance à l’effort ou un collapsus pulmonaire aigu (Root Kustritz, 2011). De plus, l’halètement est un signe de température augmentée normal chez le chien. Chez le chaton, l’halètement est dans la majorité des cas associé à une détresse respiratoire significative. La respiration bouche ouverte est, elle, considérée comme pathologique chez le chiot et le chaton (Root Kustritz, 2011).
Système digestif
Les dents
A 45 jours, le chaton possède normalement déjà une grande partie de sa dentition déciduale : incisives (101/102/103, 201/202/203, 301/302/303 et 401/402/403), canines (104, 204, 304 et 404) et prémolaires PM3 et PM4 (107/108, 207/208, 307/308 et 407/408). A environ 8 semaines d’âge, les prémolaires PM2 déciduales (106/206) font leur éruption sur la mâchoire supérieure. A l’âge de 2 mois, le chaton possède généralement toutes ses dents déciduales.
La formule dentaire de la dentition déciduale est la suivante :
2(I 3/3 ; C 1/1 ; PM 3/2) = 26 (Hoskins, 1990).
Les prémolaires PM2 ne sont présentes que sur la mâchoire supérieure chez le chat. Il ne possède pas de prémolaire PM1 dans sa dentition déciduale, ni dans sa dentition permanente. Il ne possède de molaire M1 que dans sa dentition permanente (Hoskins, 1990).
Les dents permanentes remplaceront les déciduales entre 3 et 6 mois, en commençant par les incisives 1 et 2. A 6 mois, le chat possède généralement toute sa dentition permanente (Hoskins, 1990).
Le pancréas
La flore bactérienne
À 45 jours, la nature des bactéries de la flore digestive du chaton est semblable à celle de l’adulte (Smith, 1965).
Le chaton finalise son sevrage et son régime alimentaire devient carnivore. Ces changements modifient la composition de la microflore digestive (Zabielski et al., 1999).
La digestion
- Digestion des protéines
Entre J45 et J60, le sevrage du chaton se poursuit et s’achève. Le lait est à présent exclu ou presque du régime du chaton. L’aliment solide est à présent dominant. Dans l’estomac, l’activité de la pepsine augmente parallèlement à la diminution progressive du pH stomacal (Reece, 1997).
- Digestion des glucides
Pendant cette période, le sevrage du chaton s’achève. La prise de lait devient peu significative face à l’alimentation solide (Wolter, 2011).
Les glucides apportés par l’alimentation solide sont pris en charge par des enzymes de l’intestin grêle telles que l’amylase, la maltase, la saccharase et la lactase dans l’intestin grêle. L’activité de la lactase diminue pour devenir inactive aux alentours de 2 mois. A 45 jours, la digestibilité de l’amidon cuit est de 78.5%, elle est de 80.4% à 2 mois (Wolter, 2011).
- Digestion des lipides
Le régime du chaton accueille progressivement l’alimentation solide. La lipase pancréatique permet la digestion intestinale des lipides. L’efficacité de la digestion des lipides augmente jusqu’à environ 6 mois (Harper et Turner, 2000).
Les paramètres biochimiques de la fonction hépatique
Les concentrations sanguines en alanine-aminotransférase (ALAT), aspartate-aminotransférase (ASAT), phosphatase alcalines et bilirubine totale sont présentées dans le Tableau 83.
Tableau 83 : Moyennes des paramètres biochimiques de la fonction hépatique chez le chaton à 2 mois d’âge (Von Dehn, 2014) et chez le chat adulte (Hébert, 2010).
| 2 mois | Adulte | |
| Bilirubine totale (mg/L) | 0-0,1 | 0-2,4 |
| PAL (UI/L) | 60-161 | 13-116 |
| ASAT (UI/L) | 14-40 | 10-35 |
| ALAT (UI/L) | 12-56 | 20-85 |
Système urinaire
Fonction émonctoire du rein
- Filtration glomérulaire et réabsorption tubulaire
Entre 45 jours et 2 mois d’âge, la néphrogenèse est achevée et la fonction tubulaire est efficace. La fonction rénale termine son développement (Fettman et Allen, 1991).
Le débit de filtration glomérulaire à cette période continue d’augmenter pour atteindre celui de l’adulte à l’âge de 9 semaines (Fettman et Allen, 1991).
La réabsorption tubulaire est mature entre 8 et 12 semaines. La sécrétion tubulaire est pleinement efficace entre 4 et 8 semaines (Fettman et Allen, 1991). Ainsi, le chaton acquiert la capacité à concentrer ses urines autant que le fait l’adulte (Little, 2011). Son ratio protéines sur créatinine urinaire (RPCU) est semblable à celui de l’adulte. De plus, la clairance rénale de la créatinine du chaton jusqu’à 2 mois est d’environ 1,39 à 3,59 mL/min/kg, contre 3,80 à 4,74 mL /min/kg chez le chaton de 9 à 19 semaines (Dial, 1992).
- Conséquences sur l’utilisation de médicaments en pratique
L’immaturité rénale est à prendre en compte lors de l’administration de médicaments excrétés ou métabolisés par les reins. En effet, leur clairance rénale est diminuée jusqu’à 8 semaines d’âge, ce qui peut induire des effets secondaires indésirables comme une néphrotoxicité ou une augmentation de leur durée d’action. C’est le cas notamment de la kétamine et de certains antibiotiques (céphalosporines, pénicillines, tétracyclines, trimétoprimes-sulfates) (Dial, 1992). L’antibiotique de choix cité par les auteurs est généralement le ceftiofur (2,5mg/kg par voie sous-cutanée toutes les 12 h pendant un maximum de 5 jours). L’utilisation d’anti-inflammatoires non stéroïdiens chez le chaton de moins de 2 mois est déconseillée du fait de leur toxicité rénale accrue chez ce sujet (Grundy, 2006).
- Paramètres biochimiques de la fonction rénale
La créatininémie
La créatininémie est plus faible qu’à l’âge adulte : 0,6 à 1,2 mg/dL de sang chez un chaton de 2 mois en bonne santé. Ceci peut en partie être expliqué par une masse musculaire proportionnellement plus faible Tableau 84.
Tableau 84 : Créatininémie du chaton entre 45 jours et 2 mois de vie (Giry, 2002 ; Levy et al., 2006) et du chat adulte (Hébert, 2005).
| 2 mois | 7 à 12 semaines | Adulte | |
| Créatinine (mg/dL) | 0,6-1,2 | 0,4-1,0 | 6,8-19 |
L’urémie
L’urémie chez le chaton dépend de l’alimentation et de la durée du jeûne (temps écoulé entre le dernier repas et le prélèvement sanguin). En moyenne, sa valeur est comprise entre 1,6 et 3,3 mg/dL de sang chez le chaton de 2 mois en bonne santé Tableau 85.
Tableau 85 : Urémie du chaton entre 45 jours et 2 mois de vie (Giry, 2002 ; Levy et al., 2006) et du chat adulte (Hébert, 2005).
| 2 mois | 7 à 12 semaines | Adulte | |
| Urée (mg/dL) | 1,6-3,3 | 0,53-0,81 | 8,7-31 |
Régulation hydrique et conséquences en pratique
Les besoins hydriques du chaton de moins de 2 mois sont estimés à 120 à 180 mL par kg de poids corporel, donc plus importants que l’adulte (50 à 100 mL/kg). Ceci est dû à une plus forte teneur en eau dans son organisme (80% contre 60 % pour le chat adulte), un rapport surface sur poids corporel plus important (donc des pertes par déshydratation supérieures), un métabolisme plus rapide et une masse graisseuse plus faible.
Cependant, le chaton de 45 jours à 2 mois acquiert progressivement une résistance face à la déshydratation, mais reste sensible à toute modification du volume liquidien extracellulaire (ex : diarrhée, vomissement, jeûne) (Fettman et Allen, 1991). D’un point de vue clinique, le test du pli de peau est à présent significatif, et rejoint l’humidité des muqueuses pour renseigner le vétérinaire sur l’état d’hydratation du chaton.
Miction
Comportement
Comportement alimentaire
Les chatons chassent et tuent les proies ramenées par leur mère dans le nid (Case, 2011).
Durant cette période, la mère prolonge les moments hors du nid et refuse de plus en plus la tétée à ses chatons. C’est le sevrage, processus lent et progressif, qui aboutit à la complète indépendance alimentaire du chaton vers 8 à 10 semaines. Dans la nature, le chaton reste souvent encore quelques semaines avec sa mère, en fonction de la quantité de nourriture disponible et du nombre de chats dans le voisinage (Case, 2011).
Sommeil
Comportement de jeu et de prédation
Le jeu a plusieurs intérêts. Il permet un entrainement physique musculaire mais aussi l’amélioration de la coordination et de l’équilibre. De plus, le jeu assure l’exploration de l’environnement et développe les contacts sociaux entre congénères. On distingue différents types de jeux en fonction de l’objet vers lequel le jeu est dirigé : jeux sociaux (incluent au moins un autre chat), jeux avec des objets, jeux de prédation.
- Jeux avec les objets
À cette période, le jeu avec des objets est présent chez les chatons, se développant en même temps que la coordination musculaire.
- Jeux sociaux
Les positions propres à la chasse (position aplatie, cambrure de l’arrière train, préparation du saut) sont maitrisées. La lutte entre congénères est observée à cette période. Vers 48 jours, le chaton commence à grimper sur les supports lors de courses-poursuites. Le saut est maitrisé (Beaver, 1992).
Les jeux sociaux sont majoritaires à cette période. Ils sont caractérisés par huit comportements bien définis (Beaver, 1992) :
- Le «belly-up » : le chaton se met sur le dos et montre son ventre tout en jouant avec les pattes et la bouche. A 6 semaines, ce comportement occupe 13% des jeux sociaux en moyenne et continue de prendre de l’importance ensuite.
- Le « stand-up » : le chaton est assis et joue avec ses membres antérieurs avec un congénère qui se trouve, lui, sur le dos.
- Le « side-step » : le chaton se déplace de profil autour d’un autre, avec une position arquée et la tête tournée vers lui. Ce jeu occupe à 6 semaines 42% du temps de jeu, puis son importance diminue progressivement.
- Le « vertical stance » : le chaton se positionne debout sur ses membres postérieurs en position bipède. Ce comportement n’occupe qu’une petite partie du jeu. Son importance augmente jusqu’à occuper 25% du temps de jeu à 3 mois.
- Le comportement de chasse ou course est présent.
- Le « horizontal leap » : le chaton adopte la posture du side-step puis saute sur le côté. Cette posture apparaît vers 45 jours en moyenne.
- Le « face-off » : deux chatons assis se font face, se regardent et en se penchent l’un vers l’autre, puis dirigent des coups de patte vers la face de l’autre (Beaver, 1992).
- Jeux de prédation
La prédation est présente à cette période. Ni la présence de la mère ni sa capacité à chasser ne sont essentielles au développement d’une séquence de prédation normale chez le chaton. Toutefois, la présence de la mère permet d’améliorer la manipulation, la reconnaissance des proies, et l’intérêt envers les proies (Case, 2011).
Communication verbale
Système neurologique
Capacités sensorielles
Thermorégulation
Réactions posturales
Réflexes moteurs
Réflexes liés à une stimulation tactile
Réflexes liés à la vision
Locomotion
Sang
Volémie
Système hématopoïétique
Minéraux : calcium et phosphore
Glucose
Cholestérol et triglycérides
Créatine kinase
Paramètres hépatiques
Paramètres rénaux
Système immunitaire
Organes hématopoïétiques
Réponse immunitaire
Anticorps d’origine maternelle
Conséquences sur la vaccination et calendrier vaccinal